微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:
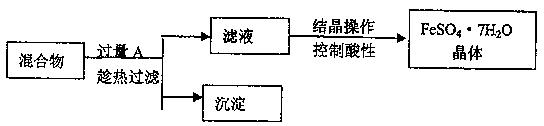
请根据题目要求回答下列问题:
(1)A的化学式为?,上述操作过程中用到的玻璃仪器有:①烧杯、②③玻璃棒、③酒精灯、④温度计、⑤?。
(2)趁热过滤的目的是?。
(3)结晶操作过程中应控制滤液酸性的原因是____?
(4)已知硫酸亚铁铵[(NH4)2Fe (SO4)2]比硫酸亚铁稳定,用在分析化学中。硫酸亚铁铵可用硫酸铵和硫酸亚铁反应制得。实验室利用硫酸亚铁铵溶液和草酸溶液反应生成草酸亚铁沉淀来制备草酸亚铁。写出硫酸亚铁铵溶液与草酸溶液反应的离子方程式____?。
(5)草酸亚铁晶体(相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。
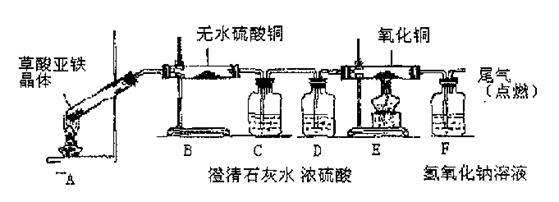
①该装置中最不合理的部分?(填字母),原因是?。
②改用正确装置实验开始后,B处变蓝,说明草酸亚 铁晶体中有?;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生?(填化学式)。
铁晶体中有?;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生?(填化学式)。
2、选择题 有四瓶常用溶液: ①BaCl2溶液 ②NaCl溶液 ③Na2SO4溶液 ④CuSO4溶液。不用其他试剂,可通过实验方法将它们一一鉴别出来,被鉴别的先后顺序是 (?)? ?
?
A.①④③②
B.①③④②
C.④①③②
D.④①②③
3、实验题 某课外小组对一些金属单质和化合物的性质进行研究。 ?
(1)下表为“铝与氯化铜溶液反应”的实验报告的一部分

按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)。置换反应________;化合反应________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是____。解释此现象的离子方程式是___________________。 ?
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼锰。 ?
①用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)________。 ?
②MnO2在H2O2分解反应中作催化剂。若将适量的MnO2加入酸化的H2O2溶液中,溶液中产生Mn2+,该反应的离子方程式是________________?。
4、实验题 为探究Cl2和SO2同时通入H2O中发生的反应,某化学兴趣小组设计了下图所示的实验装置。
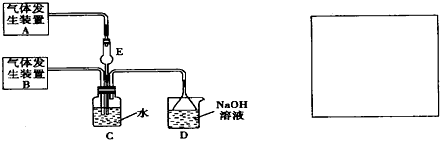
(1)化学兴趣小组的同学采用Na2SO3粉末与70%的硫酸反应制取SO2气体,采用MnO2和浓盐酸反应制取
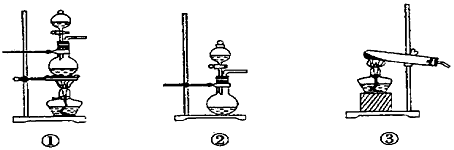
Cl2。已知SO2的溶解度比Cl2大40倍,在此实验中,E仪器的作用是___________________;发生装置B应选择以下三种装置中的____________(填序号)
(2)资料显示等物质的量的Cl2和SO2同时通入H2O中恰好反应生成两种酸,请写出反应的离子方程式
______________________。
(3)为了不影响产物的检验,小组成员认为上述整套装置有一处不合理,应在_________装置之间(填代号)连接一装置,请在装置图右边的方框中画出简易装置图,并注明装置中盛有的试剂。
(4)已知干燥的SO2和Cl2在活性炭催化剂存在下反应生成液态的SO2Cl2,反应的方程式为:
SO2(g)+Cl2(g)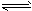 SO2Cl2(l) △H=-97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。
SO2Cl2(l) △H=-97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。
①为了提高上述反应中Cl2的平衡转化率,下列说法合理的是______________(填序号)
A、缩小容器体积 B、使用催化剂 C、增加SO2浓度 D、升高温度
②已知20℃时,AgCl的溶解度为1.5×10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是_______________。
5、实验题 (8分)用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000mol·L -1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如下:
?
| NaOH起始读数
| NaOH终点读数
|
第一次
| 0.40mL
| 18.50mL
|
第二次
| 1.30mL
| 18.05mL
|
第三次
| 3.10mL
| 21.20mL
|
?(1)达到滴定终点的时溶液颜色的变化为? ?色到?色;
?色到?色;
(2)根据以上数据可以计算出盐酸的物质的量浓度为?;
(3)以下操作造成测定结果偏高的原因可能是?。
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管