| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《原电池原理》答题技巧(2017年最新版)(八)
参考答案:D 本题解析:A项:Zn比Fe活泼,Zn是负极,故错;B项:没有气泡出现说明没有SO2和CO2生成,KMnO4酸性溶液不会变色,故错;C项:开始反应生成强电解质乙酸铵,导电性应增强,故错。故选D。 本题难度:简单 2、实验题 Al-Mg在不同的电解质溶液中分别构成原电池A、B。如下图所示: 参考答案:(1)①A池镁作负极材料,B池中铝作负极材料 ②A池:正极2H++2e-=H2↑,负极Mg-2e-=Mg2+;B池:正极6H2O+6e-=3H2↑+6OH-,负极2Al-6e-+8OH-=2AlO2-+4H2O;③池中能够发生的氧化还原反应 本题解析:在A池中可与稀硫酸发生化学反应的有镁和铝Mg+H2SO4=MgSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑由于镁的金属活泼性大于铝,所以该电池中的化学反应为Mg+H2SO4=MgSO4+H2↑,镁失电子作电池负极,铝作正极。在B池中能发生的化学反应只有铝和碱的反应,即2Al+2NaOH+2H2O=2NaAlO2+3O2↑,所以该电池中铝失电子作电池负极,而镁只能作正极。 本题难度:简单 3、填空题 氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。 |
参考答案:Ⅰ.(1) (1分)
(1分)
(2) 2NH3+NaClO=N2 H4+NaCl+H2O(2分)
(3)N2 H4(g) + O2(g) = N2(g) + 2H2O(g ) ΔH=-534 kJ·mol-1(2分)
Ⅱ.(1)C(2分)
(2)A C D(3分)
(3)0.3 mol·L-1·min-1(2分)
III.2NH3 + 6OH- + 6e- = N2 + 6H2O(2分)
本题解析:Ⅰ.(1)N2H4中的N原子可达到8电子的稳定结构,氮原子最外层3个电子形成三对共用电子对,和未成键的一对电子形成8电子稳定结构,每个氮原子和两个氢原子形成共价键,氮原子间形成一个共价键,结构式为: ,故答案为:
,故答案为: ;
;
⑵NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为:2NH3+NaClO=N2 H4+NaCl+H2O,答案:2NH3+NaClO=N2 H4+NaCl+H2O;⑶从图中读出,△H=22218kJ·mol-1-2752kJ·mol-1=-534 kJ·mol-1,所以肼燃烧生成气态水的热化学方程式为:N2 H4(g) + O2(g) = N2(g) + 2H2O(g ) ΔH=-534 kJ·mol-1,答案:N2 H4(g) + O2(g) = N2(g) + 2H2O(g ) ΔH=-534 kJ·mol-1;
Ⅱ.⑴A、应用速率之比来判断,反应过程中按照比例进行反应,故A不能判断该反应达到化学平衡状态;B、按照速率之比等于系数之比,表述的是正反应速率,当某种物质的正反应速率和逆反应速率相等是表明反应达到平衡,所以当3v(N2)正=v(H2)逆?时反应达到平衡,故B不能判断该反应达到化学平衡状态;C、当容器内压强保持不变,说明反应达到平衡,故C能判断该反应达到化学平衡状态;反应体系内质量守恒,体积一定,故混合气体的密度不变,所以混合气体的密度保持不变,不能说明反应达到平衡,故D不能判断该反应达到化学平衡状态;答案:C。
⑵A、正确,先用1.5L的容器进立与乙等效平衡,然后放大到3L,平衡向生成N2的方向即逆方向移动,所以2c1>1.5?mol·L?―1;?B、不正确,丙等效于3molH2,1molN2从正确向建立平衡,甲多加了1molN2,平衡正向移动;C、正确,反应体系内质量守恒,体积一定,混合气体的总质量甲是乙的2倍,所以混合气体的密度,2ρ1=ρ2;D、正确,温度不变,平衡常数不变,K甲= K乙= K丙。答案:A C D。
⑶v(H2)= 3v(N2)=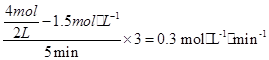 ?,答案:0.3 mol·L-1·min-1;
?,答案:0.3 mol·L-1·min-1;
III.NH3作还原剂,生成1molN2失去6mol电子,用OH―调节使方程式两边电荷守恒,负极反应,2NH3 + 6OH- + 6e- = N2 + 6H2O,答案:2NH3 + 6OH- + 6e- = N2 + 6H2O
本题难度:一般
4、选择题 一定量的锌粉和6mol·L—1的过量盐酸反应,当向其中加入少量的下列物质:①石墨 ②CuO ③铜粉 ④锌粒 ⑤浓盐酸 ⑥无水乙酸 ⑦KNO3溶液 ⑧CuCl2时,能够加快反应速率,又不响产生H2总量的是 ( )
A.①③④
B.②④⑧
C.①③⑤
D.①⑤⑦
参考答案:C
本题解析:①加入石墨,由于构成了原电池,Zn作负极,所以化学反应速率大大加快,又不响产生H2总量正确;②加入CuO时,发生产生Cu单质。由于构成了原电池,Zn作负极,所以化学反应速率大大加快,又不响产生H2总量正确;③铜粉由于构成了原电池,Zn作负极,所以化学反应速率大大加快,又不响产生H2总量,正确;④锌粒,发生速率不变,但是产生氢气的量会增加,错误;⑤浓盐酸,由于H+增加,能够加快反应速率,又不响产生H2总量⑥无水乙酸,乙酸电离产生H+,反应速率会加快,氢气的物质的量也增加,错误;⑦KNO3溶液,会产生硝酸。由于硝酸有强氧化性,一般不能产生氢气,错误;⑧CuCl2时,会发生置换反应产生氢气,反应速率会加快,但是,由于消耗了锌,最终氢气的物质的量会减少,错误。因此选项是C。
考点:考查各种外界条件对化学反应速率及产生气体的物质的量的影响的知识。
本题难度:一般
5、选择题 下图各容器中盛有稀硫酸,能形成原电池且铁为正极的是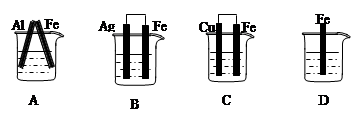
参考答案:A
本题解析:原电池的形成条件:1、有两种活泼性不同的金属(或其中一种为非金属导体)作电极;2、电极均插入电解质溶液中;3、两极相互连接(或接触);4、能自发的发生氧化还原反应。据此可知选项ABC均能形成原电池。其中金属性是Al>Fe>Cu>Ag,所以在ABC中铁分别是正极、负极、负极,答案选A。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。掌握原电池的工作原理、原电池的构成条件是答题的关键。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《物质的量》.. | |