|
|
|
高中化学知识点归纳《原电池原理》答题技巧(2017年最新版)(七)
2017-07-17 23:53:01
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列装置图或曲线图与对应的叙述相符的是
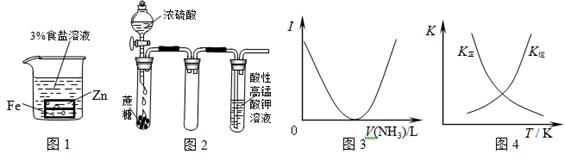
A.图1:负极反应是Fe-2e-=Fe2+
B.图2:酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去
C.图3:可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I )的变化
D.图4:可表示在恒容密闭容器中反应“2SO2(g) +O2(g) 2SO3(g) ΔH<0”的平衡常数K正、K 2SO3(g) ΔH<0”的平衡常数K正、K
| 随温度的变化
2、实验题 Al-Mg在不同的电解质溶液中分别构成原电池A、B。如下图所示:
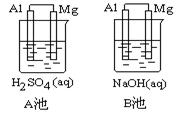
指出各池中的负极材料并写出其电极方程式。
①负极材料:
A池?,B池?。
②电极反应式:
A池:正极?,负极?。
B池:正极?,负极?。
③从构成原电池的几个组成部分来看,判断原电池的负极,除了要考虑金属的活泼性外,还要考虑?
3、填空题 氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
Ⅰ.(1)N2H4中的N原子最外层达到8电子稳定结构,写出N2H4的结构式_____________。
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为?。
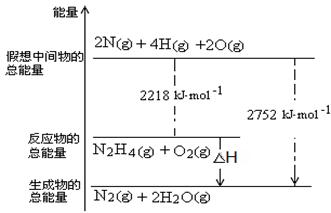
(3)肼是一种高能燃料,有关化学反应的能量变化如右图所示,写出肼燃烧的热化学方程式?。
Ⅱ.氨的合成是最重要的化工生产之一。已知:
N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1 2NH3(g)ΔH=-92.4 kJ·mol-1
在3个体积均为2L的密闭容器中,在相同的温度下,使用相同的催化剂合成氨,实验测得反应在起始、达到平衡时的有关数据如下表所示:?

试回答:
(1)下列各项能说明该反应已达到平衡状态的是______________(填写序号字母)。
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)分析上表数据,下列关系正确的是_________(填写序号字母)。
A.2c1>1.5mol·L-1
B.w3=w1
C.2ρ1=ρ2
D.K甲= K乙= K丙
|
(3)容器乙中反应从开始到达平衡平均速率为v(H2)= _____________。
III.直接供氨式碱性燃料电池的电池反应式是4NH3+3O2=2N2+6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是
__________?。
4、选择题 一定量的锌粉和6mol·L—1的过量盐酸反应,当向其中加入少量的下列物质:①石墨 ②CuO ③铜粉 ④锌粒 ⑤浓盐酸 ⑥无水乙酸 ⑦KNO3溶液 ⑧CuCl2时,能够加快反应速率,又不响产生H2总量的是 ( )
A.①③④
B.②④⑧
C.①③⑤
D.①⑤⑦
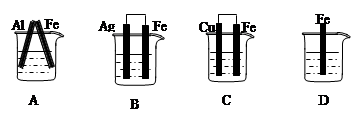
5、选择题 下图各容器中盛有稀硫酸,能形成原电池且铁为正极的是