微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列原子半径最小的是
A.F
B.P
C.O
D.Cl
参考答案:A
本题解析:试题分析:同主族自上而下原子半径逐渐增大,同周期自左向右原子半径逐渐减小,则原子半径最下的是F元素,答案选A。
考点:考查原子半径的大小比较
点评:该题是基础性试题的考查,也是高考中的常见题型,主要是考查学生灵活运用元素周期律解决实际问题的能力,有利于培养学生的逻辑推理能力,提高学生的学习效率。
本题难度:简单
2、填空题 根据已有内容的规律进行增补
(1)同族元素单质间的置换反应的化学方程式:
①2Na+2H2O=2NaOH+H2↑?②2HBr+Cl2=2HCl+Br2 ③2H2S+O2=2S+2H2O?④______
(2)已知
| 化学键 | Si-O | Si-Cl | H-Cl | Si-Si
键能/KJ?mol-1
460
360
431
176
|
回答下列问题:
①比较熔点SiCl4______SiO2(填“>”或“<”),
②工业制纯硅反应:SiCl4(g)+H2(g)=Si(s)+2HCl(g)△H=+118KJ?mol-1则H-H键能为______KJ?mol-1.
参考答案:(1)第ⅣA族元素C有强还原性,所以能和二氧化硅发生置换反应,生成硅和一氧化碳,故答案为:SiO2+2C?高温?.?Si+2CO;
(2)①化学键的键能越大,破坏化学键所需的能量越大,物质的熔点越高,由图表知,Si-O键的键能比Si-Cl键的键能大,所以SiCl4的熔点比SiO2的熔点低.
故答案为:<;
②12SiCl4(g)+H2(g)=12Si(s)+2HCl(g)△H=+118 KJ?mol-1,
△H=反应物的键能-生成物的键能=(12×360×4+H-H的键能-12×176×2-2×431)KJ?mol-1=+118 KJ?mol-1
H-H键能为436 KJ?mol-1,故答案为:436.
本题解析:
本题难度:一般
3、选择题 核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象
[? ]
A.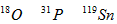
B.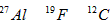
C.元素周期表中VA族所有元素的原子
D.元素周期表中第1周期所有元素的原子
参考答案:C
本题解析:
本题难度:一般
4、简答题 下表是元素周期表的一部分.
族
周期 | I?A | II?A | III?A | IV?A | V?A | VI?A | VII?A
一
|
二
a
b
?d
e
三
f
g
h
j
|
(1)表中元素的单质中熔点最高的可能是______(填元素符号);写出a的氯化物的电子式______;e、f、h形成的简单离子的半径由大到小顺序依次为______(填离子符号).
(2)在一定条件下,j与d可形成一种化合物,常温下为淡黄色液体,则其晶体类型为______.该物质遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种物质具有漂白性,写出相关反应的化学方程式______.
(3)现有一种元素,其原子获得一个电子所释放出能量是上表中所列元素中最大的,该元素是表中______元素(填编号).
(4)在g的单质中添加f单质,形成物质k,则g、f、k中硬度最大的是______(填物质名称).
(5)若制得117号元素,按元素周期表中金属与非金属的分区,它应是一种______(选填“金属”“非金属”)元素,写出117号元素最外层电子排布式______.
(6)试用短周期元素,写出两种中心原子杂化轨道类型不同的AB3型分子的化学式______、______.
参考答案:由元素在周期表中位置可知a为Li元素;b为C元素;d为N元素;e为F元素;f为Mg元素;g为Al元素;h为S元素;j为Cl元素.
(1)碳单质存在原子晶体,故碳元素单质熔点可能最高;氯化锂由锂离子与氯离子构成,电子式为
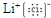
;电子层结构相同,核电荷数越大,离子半径越小,所以离子半径F->Mg2+,最外层电子数相同,电子层越多离子半径越大,所以离子半径S2->F-,所以离子半径S2->F->Mg2+;
故答案:C;
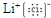
;S2->F->Mg2+;
(2)j与d形成化合物是NCl3,常温下为淡黄色液体,沸点较低,属于分子晶体.NCl3遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形为NH3,另一种物质具有漂白性是HClO,反应方程式为NCl3+3?H2O═NH3+3HClO,
故答案为:NCl3+3?H2O═NH3+3HClO;
(3)同周期自左而右,电负性增大,同主族自上而下,电负性减小.所以电负性最大是F元素,F原子获得一个电子所释放出能量最多,故答案为:e;
(4)合金的硬度高于各组分,所以铝镁合金硬度最大,故答案为:铝镁合金;
(5)第七周期0族元素为118号,所以117号元素处于第七周期第ⅦA族,最外层电子排布式为7s27p5,最外层电子数≤电子层数,属于金属元素,
故答案为:金属;7s27p5;
(6)AB3型分子可能为三角锥型,如NH3,N原子采取sp3杂化;也可能是平面三角形,如BF3,B原子采取sp2杂化,故答案为:NH3;BF3.
本题解析:
本题难度:一般
5、简答题 在下表所列的各元素组中,除一种元素外,其余都可以按某种共性归属一类.请选出各组中的例外元素,并将该组其他元素的可能归属按所给6种类型的编号填入表内.归属类型为:①主族元素;②过渡元素;③同周期元素;④同族元素;⑤金属元素;⑥非金属元素.
| 元?素 | 例外元素 | 其他元素所属类型
(1)S、N、Na、Mg
______
______
(2)Li、K、Ca、Cs
______
______
(3)Rb、B、I、Fe
______
______
参考答案:(1)S、Na、Mg位于元素周期表中的第三周期,只有N例外,位于第二周期,故答案为:N;③;
(2)Li、K、Cs位于元素周期表中的第ⅠA族,只有Ca例外,位于第ⅡA族,故答案为:Ca;④;
(3)Rb、B、I均位于元素周期表中的主族,只有Fe例外,位于过渡元素区,故答案为:Fe;①.
本题解析:
本题难度:一般
|