微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中的M的化合价为( )
A.+2
B.+3
C.+4
D.+6
参考答案:M2O7x-+3S2-+14H+=2M3++3S↓+7H2O中,
由电荷守恒可知,
(-x)+3×(-2)+14×(+1)=2×(+3),
解得x=2,
设M2O72-中的M的化合价为y,
则y×2+(-2)×7=-2,
解得y=+6,
故选D.
本题解析:
本题难度:一般
2、填空题 已知某反应中反应物与生成物有:HNO3、Cu(NO3)2、NO、Cu、H2O
(1)已知Cu在反应中失去电子,则该反应的氧化剂是______.
(2)该反应中,发生还原反应的过程是(写化学式)______→______.
(3)将反应物的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
(4)如有1.5mol?Cu参加反应,有______mol?HNO3参加反应,被还原的HNO3的物质的量是______mol.转移电子的物质的量是______?mol.
参考答案:(1)Cu在反应中失去电子,所以金属铜是还原剂,HNO3中的N元素处于最高价,所以硝酸具有氧化性,做氧化剂,故答案为:HNO3;
(2)该反应是金属铜和硝酸的反应,化合价降低的N元素发生还原反应,即从硝酸的+5价氮元素降为NO中的+2价氮元素,故答案为:HNO3→NO;
(3)该反应是金属铜和硝酸的反应,根据电子守恒来配平化学方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,电子转移的方向和数目如下所示:
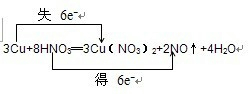
,或

,故答案为:

;
(4)根据化学方程式可以看出:当有3mol金属铜参加反应时,就有8mol的硝酸参与反应,转移电子为6mol,所以当有1.5mol金属铜参加反应时,就有4mol的硝酸参与反应,被还原的HNO3的物质的量是参加反应硝酸物质的量的四分之一,即被还原的HNO3 的物质的量是1mol,转移电子为3mol,故答案为:4;1;3.
本题解析:
本题难度:一般
3、选择题 下列反应中,水既不是氧化剂,又不是还原剂的氧化还原反应是( )
A.2Na+2H2O═2NaOH+H2↑
B.2F2+2H2O═4HF+O2
C.2Na2O2+2H2O═4NaOH+O2↑
D.MgO+H2O═Mg(OH)2
参考答案:A.Na元素的化合价升高,H元素的化合价降低,则水为氧化剂,故A不选;
B.F元素的化合价降低,O元素的化合价升高,则水为还原剂,故B不选;
C.只有过氧化钠中O元素的化合价变化属于氧化还原反应,且水中H、O元素的化合价不变,则水既不是氧化剂,又不是还原剂,故C选;
D.该反应中没有元素的化合价变化,不属于氧化还原反应,故D不选;
故选:C.
本题解析:
本题难度:简单
4、填空题 (1)1mol不同固体物质的体积各不相同,其原因是:①______,在同温同压时任何气体间一定几乎相同的是②______.
(2)在下列反应方程式中标明电子转移的方向和数目(单线桥)(该反应中H2O2只发生如下变化过程:H2O2→O2)③______
2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O?此反应中若生成标准状况下氧气6.72L,则转移电子的物质的量为④______
(3)在物质分类中硫酸氢钠除属于钠盐、可溶性盐、硫酸氢盐外还可划分为⑤______盐.
(4)一定条件下NaHSO4与Ba(OH)2反应的离子反应可写为:
H++SO42-+Ba2++OH-=BaSO4↓+H2O,则所得溶液呈⑥______性(酸性或碱性),若要所得溶液呈中性则继续反应的离子方程式为⑦______
(5)氧化还原反应是由氧化反应和还原反应组成的对立统一体如:
3Cu+8HNO3=3Cu(NO)3+2NO↑+4H2O?氧化:3Cu-6e-=3Cu2+;还原:2NO3-+6e-+8H+=2NO↑+4H2O试写出铝投入氢氧化钠溶液中发生反应的离子方程式⑧______,可拆分成氧化和还原过程:氧化:2Al-6e-+8OH-=2AlO2-+4H2O,试写出?还原:⑨______.
参考答案:(1)相同条件下决定固体物质的主要因素为微粒的大小,则1mol不同固体物质的体积各不相同是因固体微粒间的平均距离相对微粒大小可忽略,而不同的固体微粒大小不同,所以1mol不同固体物质的体积各不相同,而同温同压时任何气体间一定几乎相同是因相同条件下气体物质的分子间平均距离相同,
故答案为:固体微粒间的平均距离相对微粒大小可忽略,而不同的固体微粒大小不同,所以1mol不同固体物质的体积各不相同;分子间的平均距离;
(2)Cr元素由+6价降低为+3价,该反应中生成3molO2转移的电子为6e-,电子转移的方向和数目(单线桥)为
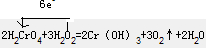
,若生成标准状况下氧气6.72L,转移电子的物质的量为6.72L22.4L/mol×2=0.6mol,故答案为:

;0.6mol;
(3)硫酸氢钠中含有硫酸根离子或硫酸氢根离子,则硫酸氢盐外还可划分为酸式或含氧酸盐,
故答案为:酸式或含氧酸;
(4)由H++SO42-+Ba2++OH-=BaSO4↓+H2O可知,碱剩余,则溶液显碱性,而使溶液为中性时继续发生酸碱中和反应,发生的离子反应为H++OH-=H2O,
故答案为:碱性;H++OH-=H2O;
(5)铝投入氢氧化钠溶液中发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,该反应中转移电子为6e-,氧化反应为2Al-6e-+8OH-=2AlO2-+4H2O,则在保证电子守恒的条件下,利用总的离子反应减去氧化反应得到还原反应为6H2O+6e-=3H2+6OH-,故答案为:6H2O+6e-=3H2+6OH-.
本题解析:
本题难度:一般
5、选择题 钢铁生锈过程发生如下反应:①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O.下列说法正确的是( )
A.反应①、②中电子转移数目相等
B.反应①、②中氧化剂是氧气
C.①、②都属于电化学腐蚀
D.①属于吸氧腐蚀
参考答案:A、反应①2Fe+O2+2H2O=2Fe(OH)2中的氧化剂是O2,反应②4Fe(OH)2+O2+2H2O=4Fe(OH)3中氧化剂也是O2,①、②两个反应中仅有O2作氧化剂且反应消耗O2的量相同,故转移电子数相等,故A正确;
B、反应①、②中氧气中氧元素化合价都降低,其它物质所含元素化合价未降低,氧化剂只有氧气,故B正确;
C、铁不纯含有碳,在弱酸性或中性环境中发生吸氧腐蚀,发生原电池反应,反应为2Fe+O2+2H2O=2Fe(OH)2,①为电化腐蚀.②4Fe(OH)2+O2+2H2O=4Fe(OH)3为普通氧化还原反应,故C错误;
D、①为电化腐蚀,有氧气参加反应为吸氧腐蚀,故D正确.
故选:ABD.
本题解析:
本题难度:简单