微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在空气中久置而不易变质的物质是
A.过氧化钠
B.纯碱
C.硅酸钠溶液
D.亚硫酸钠
参考答案:B
本题解析:试题分析:过氧化钠露置于空气中与空气中的二氧化碳、水反应分别生成碳酸钠、氢氧化钠而变质;硅酸钠溶液露置于空气中与二氧化碳气体反应生成硅酸;亚硫酸钠露置于空气中被氧气氧化成硫酸钠。
考点:元素及其化合物
点评:物质若能与空气中二氧化碳(如石灰水、漂白粉、水玻璃等)或水(如过氧化钠、碳化钙等)或氧气(亚硫酸钠、硫酸亚铁等)反应,露置于空气中易变质,应密封保存。
本题难度:简单
2、选择题 下列有关铁及其化合物的说法中不正确的是
A.工业上在高温下用CO还原含Fe2O3的铁矿石炼铁
B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4
C.工业上可用铁质容器储存、运输浓硝酸、浓硫酸
D.氯化铁溶液有较强氧化性,故可用作净水剂
参考答案:D
本题解析:A对;B中铁在纯氧中燃烧是初三内容;C中考查了钝化知识;D中氯化铁溶液作为净水剂是因为Fe3+的水解产生Fe(OH)3胶体。
本题难度:一般
3、选择题 “化学,使人类生活更美好”.下列有关说法错误的是
A.合成药物,帮助人类抵御疾病
B.亚硝酸钠既可作调味剂又可作防腐剂
C.柠檬黄可做食品着色剂,但使用过量对人体有害
D.乙醇是可再生的燃料,车用乙醇汽油值得提倡
参考答案:B
本题解析:分析:A、合成药物能有效治疗疾病;
B、亚硝酸钠是防腐剂,是致癌物质;
C、着色剂使用过量对人体有害;
D、化石燃料是不可再生资源,乙醇是可再生资源,所以车用乙醇汽油值得提倡.
解答:A、有些治疗疾病的药品不能从天然药物中提取,只能人工合成,所以主要利用合成药物帮助人类抵御疾病,故A正确;
B、亚硝酸钠能抑制微生物的繁殖,所以是一种防腐剂,而且还有抗氧化作用,但亚硝酸钠会与肉类的蛋白质反应生成一种致癌的化合物亚硝胺,亚硝酸钠有毒,所以亚硝酸钠不能作调味剂,故B错误;
C、在规定范围内使用着色剂,一般认为对人体健康无害,但超量使用对人体有害,故C正确;
D、乙醇可以通过粮食发酵或化工合成等方法制得,是与汽油按照一定的比例进行配比的一种新型燃料,化石燃料不是可再生资源,所以使用乙醇汽油既可作汽车的可再生的燃料,又可可节省石油资源,故D正确;
故选B.
点评:本题考查了化学与生活知识,注意亚硝酸盐有毒,不能作调味剂,一些腌制肉类食品中都加入了亚硝酸钠,它不仅是防腐剂还有抗氧化作用.
本题难度:困难
4、选择题 下列叙述中,正确的是
A.含金属元素的离子一定是阳离子
B.金属离子只能被还原,不能被氧化
C.金属氧化物不一定都是碱性氧化物
D.金属元素在化合物中既可显正价也可显负价
参考答案:C
本题解析:
本题难度:简单
5、选择题 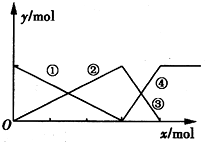 如图表示AlCl3溶液与NaoH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是
如图表示AlCl3溶液与NaoH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是
A.①线表示Al3+的物质的量的变化
B.x表示AlCl3的物质的量
C.③线表示Al(OH)3的物质的量的变化
D.④线表示的物质的量的变化
参考答案:B
本题解析:分析:假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,
假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗 molAl3+,生成
molAl3+,生成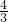 molAl(OH)3↓,前后两部分消耗的Al3+为1mol:
molAl(OH)3↓,前后两部分消耗的Al3+为1mol: mol=3:1,
mol=3:1,
由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,据此结合选项解答.
解答:假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,
假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗 molAl3+,生成
molAl3+,生成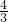 molAl(OH)3↓,前后两部分消耗的Al3+为1mol:
molAl(OH)3↓,前后两部分消耗的Al3+为1mol: mol=3:1,
mol=3:1,
由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,
A.由上述分析可知,首先发生反应Al3++3OH-=Al(OH)3↓,溶液中铝离子物质的量减少,①线表示Al3+的物质的量的变化,故A正确;
B.由上述分析可知,X表示NaOH溶液,故B错误;
C.由上述分析可知,随反应进行Al(OH)3物质的量先增大,或减小,故②③线表示Al(OH)3的物质的量的变化,故C正确;
D.由上述分析可知,Al(OH)3溶解时,AlO2-的物质的量增大,④线表示AlO2-的物质的量的变化,故D正确;
故选B.
点评:本题考查镁铝重要化合物、离子反应、化学计算等,难度较大,根据相互滴加过程离子物质的量的变化确定图象表示向AlCl3溶液中滴加NaOH溶液是解题的关键.
本题难度:简单