微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 分别与1mol?Cl2发生反应,消耗质量最小的物质是
A.Fe
B.Cu
C.Mg
D.Na
参考答案:C
本题解析:分析:依据氧化还原反应的电子守恒分析计算;
解答:依据氧化还原反应的电子守恒;Cl2~2Cl-~2e-;Fe~Fe3+~3e-;Cu~Cu2+~2e-;Mg~Mg2+~2e-;Na~Na+~e-;得到3Cl2~2Fe~3Cu~3Mg~6Na;即Cl2~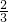 Fe~Cu~Mg~2Na
Fe~Cu~Mg~2Na
1mol氯气反应消耗的金属质量分别为:m(Fe)=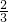 mol×56g?mol-1=37.3g;
mol×56g?mol-1=37.3g;
m(Cu)=1mol×64g?mol-1=64g;
m(Mg)=1mol×24g?mol-1=24g;
m(Na)=3mol×23g?mol-1=69g;
故选C.
点评:本题考查了氯气的化学性质,与金属反应的定量计算,特别注意与铁的反应.
本题难度:困难
2、选择题 甲试管中盛有0.5mol/L?Na2CO3溶液10mL,慢慢往试管中加入1mol/L的盐酸7.0mL;乙试管中盛有1mol/L的盐酸7.0mL,慢慢往试管中滴加0.5mol/L?Na2CO3溶液10mL,那么甲、乙两试管中产生的CO2物质的量大小关系为
A.甲=乙
B.甲>乙
C.甲<乙
D.无法确定
参考答案:C
本题解析:由于碳酸钠和盐酸的反应是分步进行的,即方程式为Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。所以根据方程式可知,乙中生成的CO2多,答案选C。
本题难度:困难
3、选择题 用瓷坩埚盛放镁粉进行强热使之燃烧,充分反应后生成的固体产物可能有
A.2种
B.3种
C.4种
D.5种
参考答案:D
本题解析:镁粉在空气中燃烧时,镁粉除与氧气化合形成MgO外,还能与N2、CO2反应生成Mg3N2和C、MgO。但在瓷坩埚里高温燃烧时镁还能与瓷坩埚中的SiO2反应生成Si:
SiO2+2Mg 2MgO+Si
2MgO+Si
Si与Mg也可能反应生成Mg2Si:
Si+2Mg Mg2Si
Mg2Si
故产物有5种(MgO,Mg3N2,C,Si,Mg2Si)。
本题难度:简单
4、选择题 甲醛(分子式HCHO)为较高毒性的物质,已经被世界卫生组织确定为致癌和致畸形物质,是公认的变态反应源和强致突变物之一.若将3.0g的甲醛HCHO气体与足量氧气充分燃烧后,立即将全部燃烧产物通入足量的Na2O2固体,充分反应后,固体质量增加
A.3.0g
B.4.2g
C.8.4g
D.无法计算
参考答案:A
本题解析:分析:H2和CO与氧气反应生成二氧化碳和水,二氧化碳和水与过氧化钠反应,都使Na2O2粉末增重,HCHO相当于H2和CO按1:1混合,据此来分析.
解答:因为H2和CO与氧气反应生成二氧化碳和水,二氧化碳和水与过氧化钠反应,都使Na2O2粉末增重,
根据方程式2CO+O2=2CO2;2H2+O2=2H2O;HCHO+O2=CO2+H2O,2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2↑可知,
二氧化碳与过氧化钠反应增重为开始CO的质量,水与过氧化钠反应增重为开始H2的质量,
HCHO(g)与氧气反应生成二氧化碳和水,HCHO相当于H2和CO按1:1混合,其燃烧生成二氧化碳和水,
所以3.0g的 甲醛HCHO气体与足量氧气充分燃烧后,立即将全部燃烧产物通入足量的Na2O2固体,使Na2O2粉末增重为HCHO的质量.
故选A.
点评:解题关键清楚:1、若HCHO(g)、H2和CO组成的混合气体完全燃烧,则Na2O2粉末增重为混合气体的质量,若不能完全燃烧则Na2O2粉末增重小于混合气体的质量;
2、根据方程式判断混合物完全燃烧需氧气量.
本题难度:简单
5、选择题 二氧化硅有下列性质:
①能和氢氟酸反应
②能和氧化钙反应
③能和氢氧化钠反应
④不能和水反应,这些性质中有别于一般酸性氧化物的性质是
A.①②③④
B.①④
C.①②
D.②④
参考答案:B
本题解析:
本题难度:一般