|
高中化学知识点讲解《物质的量》考点强化练习(2017年押题版)(十)
2017-07-18 00:00:01
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 相同质量的下列气体中,所含原子数最多的是( )
A.CH4
B.N2
C.CO
D.O2
|
参考答案:A
本题解析:根据物质的化学式和摩尔质量可知,选项A、B、C、D中含有的原子的物质的量分别是(mol)5m/16、2m/28、2m/28、2m/32,所以答案选A。
本题难度:一般
2、填空题 (13分)实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
应量取盐酸体积/mL
| 应选用容量瓶的规格/mL
| 除容量瓶外还需要的其它仪器
|
|
|
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2—3cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 。
溶液注入容量瓶前需恢复到室温,这是因为_______________________________。
(4)若出现如下情况,对所配溶液浓度将有何影响?没有进行A操作 ;加蒸馏水时不慎超过了刻度 ;定容时俯视__________(填“偏低”“偏高”“无影响”)
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度 ;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面 。
参考答案:(1)2.1,250,量筒、烧杯、玻璃棒、胶头滴管。(2)B、C、A、F、E、D
(3)保证溶质全部转入容量瓶。容量瓶盛放热溶液时,体积不准。(4)浓度偏低;偏低;偏高。
(5)宣告实验失败,洗净容量瓶后重新配制;宣告实验失败,洗净容量瓶后重新配制。
本题解析:(1)浓盐酸的物质的量浓度为:C=1000pw%/M=(1000×1.18×36.5%)/36.5==11.8mol/L;设量取浓盐酸的体积为V,11.8mol/L×V=0.1mol/L×0.25L,V=0.0021L=2.1mL;选用250ml的容量瓶,配制盐酸溶液所需的仪器有量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,所以除容量瓶外还需要的其它仪器有量筒、烧杯、玻璃棒、胶头滴管,答案为:2.1;250;量筒、烧杯、玻璃棒、胶头滴管;
(2)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,所以配制时,其正确的操作顺序是BCAFED,(3)操作A中,将洗涤液都移入容量瓶,其目的是保证溶质全部转入容量瓶;因为容量瓶只能盛放室温下的溶液,溶液注入容量瓶前需恢复到室温;
(4)没有进行A操作,导致溶质的物质的量偏小,配制溶液的浓度偏低,答案为:偏低;加蒸馏水时不慎超过了刻度,导致溶液的体积偏大,配制溶液的浓度偏低,答案为:偏低;定容时俯视偏低,导致溶液的体积偏小,配制溶液的浓度偏高,答案为:偏高。
(5)加蒸馏水时不慎超过了刻度或者向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,只能是宣告实验失败,洗净容量瓶后重新配制。
考点:考查一定物质的量浓度溶液的配制及误差分析等知识。
本题难度:困难
3、填空题 (6分)物质的量相等的 CO 和 CO2中,分子个数之比为?;原子个数之比为?;氧原子个数比为?。
参考答案:? 1:1?;? 2:3?;? 1:2
本题解析:略
本题难度:一般
4、选择题 NA表示阿伏加德罗常数的值,下列说法中正确的是
A.常温常压下,0.05 NA个CO2分子所占的体积是1.12L
B.氨气的摩尔质量和NA个氨分子的质量相等
C.常温常压下,32g O2和34g H2S气体分子个数比为1:1
D.标准状况下, NA个水分子所占的体积约为22.4L
参考答案:C
本题解析:A项的温度和压强应该是标准状况下,B项氨气的摩尔质量在数值上和NA个氨分子的质量相等,摩尔质量是个物理量不能和质量相等,D项水标准状况下是固态,不能用22.4L来表示。答案选C。
点评:阿伏伽德罗常数是历年高考的“热点”问题。多年来全国高考化学试题出现的几率为100%。这双因为它既考查了学生对物质的量与粒子数、质量、气体体积和物质的量浓度之间的关系,又可以与物质结构、盐类水解、弱电解质的电离等其他的概念性知识点结合成综合性习题。
本题难度:一般
5、填空题 (12分)氯气是一种重要的工业原料。
Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是?。
Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:
Ca(ClO)2+CaCl2+2H2SO4? ?2CaSO4+2Cl2↑+2H2O ?2CaSO4+2Cl2↑+2H2O
他们利用该反应设计如下制取氯气并验证其性质的实验。

(1)回答下列问题:(1)该实验中A部分的装置是??(填标号) 。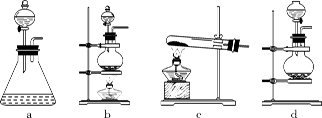
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):?。
(3)写出D装置中发生反应的离子方程式?(4)该实验存在明显的缺陷,请你提出改进的方法?。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取出25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L?1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2 ===? Na2S4O6+2NaI,共用去Na2S2O3溶液20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为?。
参考答案:Ⅰ.MnO2 + 4HCl(浓) 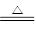 ?MnCl2 + Cl2↑+ 2H2O? (2分) ?MnCl2 + Cl2↑+ 2H2O? (2分)
Ⅱ.(1)b (2分)
(2) 取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化?(2分)
(3) Cl2+H2O ="==" H++Cl?+HClO?
H++HCO3? ="==" CO2↑+H2O?(合理答案均可,共2分)
(4) 应将尾气通入NaOH溶液中?(2分)
(5) 35.75%?(2分)
本题解析:Ⅰ实验室可用二氧化锰和浓盐酸反应制取氯气的化学方程式:MnO2 +4HCl(浓)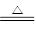 MnCl2 +Cl2↑+2H2O。 MnCl2 +Cl2↑+2H2O。
Ⅱ⑴A部分是氯气的发生装置,而此装置为固液加热型装置,因此选b。
⑵证明洗气瓶C中的Na2SO3已被氧化,实际上是证明溶液中存在SO42-。
⑶装置D中为碳酸氢钠与氯气的反应,,此时应考虑氯气溶液水发生的反应。故答案为:
Cl2+H2O=H++Cl?+HClO、H++HCO3?=CO2↑+H2O。
⑷整个反应过程中由于氯气具有毒性,因此,装置的末尾应加上一个尾气处理装置。可用碱性溶液吸收。
⑸由此过程中涉及的反应式可得出如下关系式: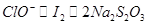 ,所以得: ,所以得: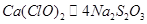
143? 4mol
x? 0.002mol?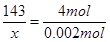 ?解得 ?解得 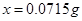
故该漂白粉中Ca(ClO)2的质量分数为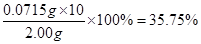
点评:本题是一道结合实验与计算的综合题,属于中等难度题型,也是高考中的常考题型。对于此类题型的解答,熟练掌握物质的相关性质,是解题关键。对于计算,则需将多步反应联系起来,找出之间的对应关系,形成关系式形式,可简化计算,减少计算量。
本题难度:一般
|