微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是(? )
A.需要加热的化学反应都是吸热反应
B.16 8O2和18 8O2互为同位素,性质相似
C.化学反应中的能量变化,只表现为热能的变化
D.由“C(s, 石墨)= C(s, 金刚石)△H =+1.9 kJ/mol”知石墨比金刚石稳定
参考答案:D
本题解析:反应的条件与反应是否吸热没有直接的关系;16? 8O2和18? 8O2属于同种物质,只不过原子核内的中子数不同而已;化学反应中能量有多种表现形式,比如热能、电能、光能等
本题难度:一般
2、选择题 下列说法正确的是(? )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了放热还是吸热
D.C(石墨,s)=C(金刚石,s)△H>0,所以金刚石比石墨稳定
参考答案:C
本题解析:A.放热反应好多也需要加热才能发生;
B.铝热反应需在高温条件下才能发生,所以并非所有放热反应在常温条件下一定能发生反应;
D.C(石墨,s)=C(金刚石,s)△H>0,石墨到金刚石需吸热,石墨能量低,石墨更加稳定。
点评:考查吸放热反应;能量越低,物质越稳定;
本题难度:简单
3、选择题 热化学方程式 2H2(气) + O2(气) = 2H2O(气),△H=- 483.6 kJ/mol ,其中化学计量(系数)表示的是(?)
A.体积数
B.物质和质量
C.物质的量
D.物质的质量
参考答案:C
本题解析:在热化学方程式中化学计量数表示参加反应的物质的物质的量,答案选C。
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固与训练,有助于调动学生的学习兴趣,提高学生的学习效率。
本题难度:简单
4、填空题 X、Y、Z、W均为10电子的分子或离子。X有5个原子核。通常状况下,W为无色液体。它们之间转化关系如图所示,请回答:
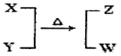
(1)工业上每制取1molZ要放出46.2 kJ的热量,写出该反应的热化学方程式:?。
(2)工业制取Z的化学平衡常数K与T的关系如下表:
T/K
| 298
| 398
| 498
| ……
|
K/(mol·L—1)—2
| 4.1×106
| K1
| K2
| ……
|
?
请完成下列问题:
①试比较K1、K2的大小,K1??K2(填写“>”“=”或“<”)
②恒温固定体积的容器中,下列各项能作为判断该反应达到化学平衡状态的依据的是 ?(填序号字母)。
A.容器内各物质的浓度之比为化学计量数比
B.混合气体密度保持不变
C.容器内压强保持不变
D.混合气体相对分子质量保持不变
(3)某化学小组同学模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。
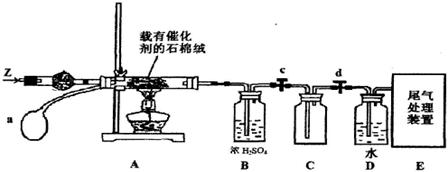
①A中发生反应的化学方程式是?。
②B中浓H2SO4的作用是?。
(4)写出D装置中反应的化学方程式?。
(5)a中通入空气的作用?。
参考答案:(1)N2(g)+3H2 2NH3(g)? ΔH=—92.4KJ/mol(3分)
2NH3(g)? ΔH=—92.4KJ/mol(3分)
(2)?① >?②CD
(3)①4NH+5O2 4NO+6H2O?②吸收水和多余的氨气
4NO+6H2O?②吸收水和多余的氨气
(4)3 NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3
(5)氧化NH3和NO
本题解析:(1)5个原子核的10电子的微粒一般为CH4、NH4+NH4+,W为无色液体,10电子的无色液体为H2O,所以猜想该反应为NH4+与OH-制取NH3的反应,X为NH4+,Y为OH-,Z为NH3。工业制取氨气的化学反应为N2+3H2 2NH3,每制取1molNH3要放出46.2kJ的热量,所以该反应的热化学方程式为N2(g)+3H2
2NH3,每制取1molNH3要放出46.2kJ的热量,所以该反应的热化学方程式为N2(g)+3H2 2NH3(g)? ΔH=—92.4KJ/mol
2NH3(g)? ΔH=—92.4KJ/mol
(2)①制取氨气的反应为放热反应,升高温度有利于平衡逆向移动,平衡常数减小,所以K1>K2
②A、达平衡时容器内各物质的浓度之比不一定为化学计量数比,错误;B、恒容的容器中,气体的密度始终不变,错误;C、随着反应的进行,气体的压强逐渐减小,达平衡时不再变化,正确;D、随着反应的进行,气体的物质的量逐渐减小,气体的相对分子质量逐渐增大,达平衡时不再变化,正确,答案选CD。
(3)①A中发生反应是氨气的催化氧化,其化学方程式是4NH+5O2 4NO+6H2O
4NO+6H2O
②浓H2SO4具有吸水性,也可以和氨气反应,所以B中浓H2SO4的作用是吸收水和多余的氨气
(4)由于空气的不断鼓入,二氧化氮与水、氧气完全反应生成硝酸,化学方程式为4NO2+O2+2H2O=4HNO3或3 NO2+H2O=2HNO3+NO
(5)a中通入空气的作用就是不断氧化NH3和NO
本题难度:困难
5、选择题 下列说法正确的是
A.H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)=2H2(g)+O2(g)△H=+571.6 kJ/mol
B.反应物的总能量低于生成物的总能量时,该反应为放热反应
C.由石墨比金刚石稳定可知:c(金刚石,s)=c(石墨,s)△H<0
D.已知:298K时,N2(g)+3H2(g) 2NH3(g)△H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入1/2 mol N2和3/2 mol H2,达到平衡时放出46.0 kJ的热量
2NH3(g)△H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入1/2 mol N2和3/2 mol H2,达到平衡时放出46.0 kJ的热量
参考答案:C
本题解析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的能量,氢气的稳定氧化物是液态水,A不正确。反应物的总能量低于生成物的总能量时,该反应为吸热反应,反之是放热反应,B不正确。能量越低,越稳定,由此石墨的能量低于金刚石的,所以金刚石生成石墨的反应是放热反应,C正确。氨气的合成是可逆反应,1/2 mol N2和3/2 mol H2不可能生成1mol氨气,所以放出的热量低于46.0 kJ,D不正确。答案选C。
本题难度:一般