| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《氯及其化合物》试题预测(2017年最新版)(二)
 参考答案:A.Cl2与NaOH溶液反应而导致锥形瓶内压强减小,小气球a鼓起,故A正确; 本题解析: 本题难度:简单 2、选择题 一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( ) |
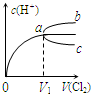
参考答案:A、加水稀释促进次氯酸的电离,氢离子的物质的量增多,但体积增大,氢离子浓度反而减小,溶液中c(H+)变化如曲线c,故A错误;
B、将饱和氯水升高温度,Cl2的溶解度随温度升高而迅速降低,溶液中c(H+)应减小,溶液中c(H+)变化如曲线c,故B错误;
C、任何溶液都满足电中性,在饱和氯水中加入NaOH使pH>7,溶液中存在下列关系:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(ClO-),故C正确;
D、溶液PH=7时,次氯酸过量,溶液中存在:c(Cl-)=c(HClO)+c(ClO-),c(Cl-)>c(ClO-),故D错误;
故选C.
本题解析:
本题难度:简单
3、选择题 在100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L-1和0.1 mol·L-1,向该混合液中加入1.92 g铜粉,加热充分反应后,所得溶液中Cu2+的物质的量浓度是( )
A.0.15 mol·L-1
B.0.225 mol·L-1
C.0.35 mol·L-1
D.0.45 mol·L-1
参考答案:B
本题解析:先分别计算出n(H+)=0.06 mol,n(NO)=0.04 mol,n(Cu)=0.03 mol;再根据离子方程式:3Cu+2NO+8H+===3Cu2++2NO↑+4H2O可知,n(NO)和n(Cu)过量,n(H+)的量不足,根据n(H+)和上述离子方程式计算出生成的n(Cu2+)即可。
本题难度:一般
4、实验题 二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110 ℃~140 ℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表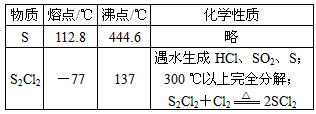
设计实验装置图如下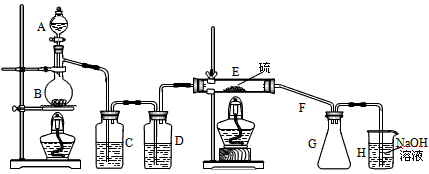
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见_____________________________。利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式___________________________________;E中反应的化学方程式____________________________________。
(3)C、D中的试剂分别是______________、_____________。
(4)仪器A、B的名称是__________、___________,F的作用是____________________________。
(5)如果在加热E时温度过高,对实验结果的影响是___________________________,在F中可能出现的现象是_________________________。
(6)S2Cl2粗品中可能混有的杂质是(填写两种)_____________、____________,为了提高S2Cl2的纯度,关键的操作是控制好温度和______________________。
参考答案:(1)用导管将A的上口和B相连(或将A换成恒压滴液漏斗),在G和H之间增加干燥装置
(2)MnO2+4H++2Cl-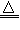 Mn2++Cl2↑+2H2O;2S+Cl2
Mn2++Cl2↑+2H2O;2S+Cl2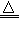 S2Cl2
S2Cl2
(3)饱和食盐水(或水);浓硫酸。
(4)分液漏斗;蒸馏烧瓶;导气、冷凝
(5)产率降低(或S2Cl2分解);有固体产生(或其他正确描述)
(6)SCl2;Cl2(或S);控制浓盐酸的滴速不要过快
本题解析:
本题难度:困难
5、填空题 下图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹。(氯气在饱和氯化钠溶液中的溶解度较小。)
(1)仪器A的名称是?;水槽中应盛放的是?;烧杯中盛放的是?;烧瓶中反应的化学方程式?;
在收集氯气时,应打开?关闭? (填a, b)当氯气收集完毕,尾气处理时烧杯中发生反应的离子方程式?。
参考答案:(1)分液漏斗?饱和食盐水?氢氧化钠溶液
4HCl(浓)+MnO2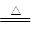 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)a? b? Cl2 + 2OH-=Cl- + ClO- + H2O
本题解析:(1)根据仪器特点可知A为分液漏斗;根据信息氯气在饱和氯化钠溶液中的溶解度较小,实验室常用排饱和食盐水法收集氯气;实验室常用二氧化锰和浓盐酸在加热条件下制取氯气,化学方程式为4HCl(浓)+MnO2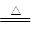 MnCl2+Cl2↑+2H2O;(2)根据题给装置图分析,收集氯气时,应关闭b,打开a;收集完毕,关闭a,打开b,多余的气体通入氢氧化钠溶液进行吸收,防止污染空气,离子方程式为Cl2 + 2OH-=Cl- + ClO- + H2O。
MnCl2+Cl2↑+2H2O;(2)根据题给装置图分析,收集氯气时,应关闭b,打开a;收集完毕,关闭a,打开b,多余的气体通入氢氧化钠溶液进行吸收,防止污染空气,离子方程式为Cl2 + 2OH-=Cl- + ClO- + H2O。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《新型材料》.. | |