微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E五种短周期元素,原子序数依次增大,A原子的最外层电子排布式为nsnnpn+1,C、D原子核外都有一个未成对电子,又知B和E为同一主族,C、D、E为同周期,且B、E的原子序数之和等于C、D的原子序数之和
(1) E离子的基态电子排布式 _______________
(2)元素B、C、D、E的原子半径从大到小的顺序是________(用元素符号填写,下同)
(3)元素A、B、C、D的第一电离能从大到小的顺序是
(4)写出C单质与B单质加热时生成的化合物的电子式
(5) D元素在周期表中的位置是_______________,中学化学实验室中制取D的最高价氧化物对应的水化物的离子方程式为___________________________________
(6)已知:①A2(g)+B2(g)=2AB(g) ΔH1=akJ/mol
②2AB(g)+B2(g)=2AB2(g) ΔH2=bkJ/mol
③AB(g)+AB2(g)= A2B3(g) ΔH3=ckJ/mol
则2A2(g)+3B2(g)=2A2B3(g) ΔH= kJ/mol (用a.b.c表示)
参考答案:(每空2分,共14分)
(1) 1s22s22p63s23p6
(2) Na>Al>S>O
(3)N>O>Al>Na
(4)Na+[: :
: :]2-Na+
:]2-Na+
(5) 第三周期,ⅢA族, Al3+ +3NH3·H2O=Al(OH)3↓+3NH4+
(6) ΔH=(2a+b+2c)kJ/mol
本题解析:由A的电子层结构,可以推知为2s22p3,为N,又B和E为同一主族,C、D、E为同周期,B为O或F,C、D、E为第三周期,外层有一个未成对电子的可能为Na和Al,从而确定B为O、E为S。
(1)要注意为S的离子
(2)原子半径先比较电子层,电子层越多半径越大,再比较核电荷数,越多半径越小
(3)第一电离能整体上同周期从左到右为增大趋势,同主族从上到下,减小;这里N为半充满,反常。
(4)Na2O2的电子式
(5)Al的位置以及制备Al(OH)3,要考虑氢氧化铝的两性,既能溶于酸又能溶于碱,故不能用强碱,用氨水。
(6)由盖斯定律有目标反应等于①×2+②+③×2
考点:以物质结构为基础,考查了原子结构、元素周期表和周期律、盖斯定律和热化学方程式的书写。
本题难度:困难
2、填空题 铜单质及其化合物在工业生产和科研中有重要作用。
(1)已知:2Cu2O(s) + O2(g) = 4CuO(s)△H=-292kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式: ;
(2)现用氯化铜晶体(CuCl2·2H2O,含氯化亚铁杂质)制取纯净的CuCl2·2H2O。先将其制成水溶液,后按如图步骤进行提纯:
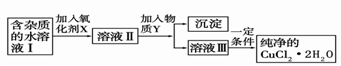
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表
金属离子
| Fe3+
| Fe2+[来源:学&科&
| Cu2+
|
氢氧化物开始沉淀时的pH
| 1.9
| 7.0
| 4.7
|
氢氧化物完全沉淀时的pH
| 3.2
| 9.0
| 6.7
|
请回答下列问题:
①现有氧化剂NaClO、H2O2、KMnO4,X加哪种好,为什么?
;该反应的离子方程式为 。
②溶液II中除Cu2+外,还有 金属离子,如何检验其存在 。
③物质Y不能为下列的
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 e.CaO f.NaOH
④若向溶液Ⅱ中加入碳酸钙,产生的现象是 。
参考答案:(1)C(s)+2CuO(s)=CO(g)+Cu2O(s) △H=+35.5kJ·mol-1(2分)
(2)①H2O2好,不引入杂质离子(2分)。
H2O2+2Fe2++2H+=2 Fe3++2H2O(2分)
②Fe3+(1分),取少量溶液于试管中,滴加KSCN溶液,若溶液变红色,证明含Fe3+。若溶液不变红色,则证明不含Fe3+。(2分)
③ef(2分)
④碳酸钙溶解,产生气泡和红褐色沉淀(1分)
本题解析:(1)利用盖斯定律,
①2Cu2O(s) + O2(g) = 4CuO(s)△H=-292kJ·mol-1
②2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
用②-①可以得到:C(s)+2CuO(s)=CO(g)+Cu2O(s) △H=+35.5kJ·mol-1(2分)
(2)①高锰酸钾和次氯酸钠作氧化剂的话,都要会引入杂质离子,便是H2O2是绿色氧化剂,不引入杂质离子(2分)。H2O2+2Fe2++2H+=2 Fe3++2H2O(2分)②Fe3+(1分),取少量溶液于试管中,滴加KSCN溶液,若溶液变红色,证明含Fe3+。若溶液不变红色,则证明不含Fe3+。(2分)③溶液Ⅱ是酸性溶液,加入含铜的物质可以调节溶液的pH值,对于ef而言,虽然可以调节溶液的pH值,但是引进了杂质离子。(2分)④碳酸钙溶解,产生气泡和红褐色沉淀(1分)
考点:考查热化学,物质的提纯。
本题难度:困难
3、填空题 已知:H2O(g)=H2O(l);△H=-44.0kJ/mol,将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_______________。则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
参考答案:B2H6(g)+3O2(g)==B2O3(s)+3H2O(l)△H=-2165kJ/mol;1016.5
本题解析:
本题难度:一般
4、选择题 已知25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol-1、285.8 kJ·mol-1、
890.3 kJ·mol-1、2 800 kJ·mol-1,则热化学方程式正确的是
[? ]
A.C(s)+1/2O2(g)====CO(g) ΔH=-393.5 kJ·mol-1
B.2H2(g)+O2(g)====2H2O(g) ΔH=+571.6 kJ·mol-1
C.CH4(g)+2O2(g)====2H2O(g)+CO2(g) ΔH=-890.3 kJ·mol-1
D.1/2C6H12O6(s)+3O2(g)====3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
参考答案:D
本题解析:
本题难度:简单
5、简答题 (14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
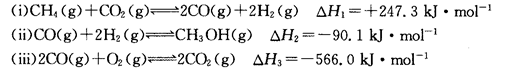
(1)用CH4和02直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向4 L恒容密闭容器中通人6 mol C02和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为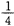 ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
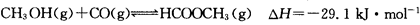 ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
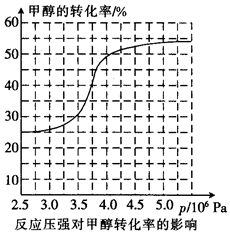

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5× 106 Pa” “4.O×106 Pa”或“5.0× 106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
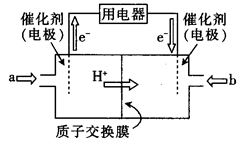
①通入a气体的电极是电池的 (填“正”或“负”)极,其电极反应式为 .
②常温下,用此电池以惰性电极电解O.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为 (忽略溶液的体积变化)。
参考答案:(1)2CH4(g)+02(g)?2CH3OH(g)△H=-251.6 kJ/mol
(2)1 33.3%
(3)①4.0×106Pa。
②80℃时速率大且高于80℃时速率变化不明显,又因为升温化学平衡逆向移动,转化率降低。
(4)①甲醇、CH3OH-6e-+H2O=CO2+6H+
②13
本题解析:(1)由盖斯定律知(i)×2+(ii)×2+(iii)得2CH4(g)+02(g)?2CH3OH(g)其△H=(+247.3kJ/mol)×2+(-90.1 kJ/mol)×2+(-566.0 kJ/mol)="-251.6" kJ/mol(2)利用三行式:设反应消耗CH4物质的量为n
CH4(g)+C02(g)?2CO(g)+2H2(g)
起始n/mol 6 6 0 0
变化n/mol n n 2n 2n
平衡n/mol 6-n 6-n 2n 2n
由题意得:2n/(12+2n)="1/4" 解得n=2mol
K=(12×12)/(1×1)=1
CO转化率为(2/6)×100%=33.3%(3)①由图可知, 3.5× 106 Pa 到4.O×106 Pa 之间甲醇转化率提高最明显,且4.0×106Pa时甲醇转化率已经较高,故工业制取甲酸甲酯选择的压强为4.0×106Pa。②图像中80℃时速率大且高于80℃时速率变化不明显,又因为该反应为放热反应升温不利反应正向进行,所以实际采用的温度是80℃。(4)①由DMFC的工作原理图示,根据电子流动方向判断a为负极通入的为甲醇。电极反应方程式为:CH3OH-6e-+2H2O=CO2+6H+②惰性电极电解O.5 L饱和食盐水,两极共生成气体0.05mol即氢气、氯气各0.025mol由反应2Cl-+2H2O=Cl2↑+H2↑+2OH-可得C(OH-)=0.05mol/0.5L=0.1mol/L所以PH=13
考点:理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。了解化学平衡常数的含义,能利用化学平衡常数进行相关计算。理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。 了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
点评:本题考查热化学方程式的书写及盖斯定律的应用、化学平衡常数的求算、利用影响化学反应速率与化学平衡的因素控制化学反应的进行,电化学方程式的书写有简单计算,考查对知识理解能力与综合运用能力。
本题难度:困难