微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:
(1)用太阳能分解5mol液态水消耗的能量是______kJ;
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为______;
(3)在以甲醇为燃料的燃料电池中,电解质溶液为酸性,则正极的电极反应式为______;?理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______.(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
参考答案:(1)H2的燃烧热△H分别为-285.8kJ?mol-1,分解5mol液态水消耗的能量为5mol×285.8kJ?mol-1=1429kJ,
故答案为:1429kJ;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ?mol-1和-726.5kJ?mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ?mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-726.5kJ?mol-1-(-283.0kJ?mol-1)=-443.5kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1;
(3)甲醇燃料电池,甲醇在负极失电子发生氧化反应,氧气在正极放电,酸性条件下生成水,正极电极反应式为:O2+4e-+4H+═2H2O,
CH3OH(l)的燃烧热△H=-726.5kJ?mol-1,故2mol甲醇完全燃烧放出的热量为2mol×726.5kJ?mol-1=1453kJ,故该燃料电池的理论效率为1162.4kJ1453kJ=80%,
故答案为:O2+4e-+4H+═2H2O;80%.
本题解析:
本题难度:一般
2、填空题 制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下:
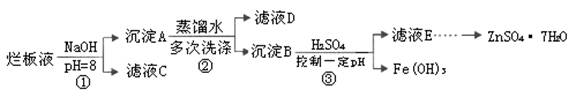
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式 。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是 (填选项)。
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是: 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
②H2O(l)  H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
请写出Fe3+发生水解反应的热化学方程式: 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K= 。(用含KSP、KW的代数式表示)
参考答案:(1)1:2
(2)Zn(OH)2+2OH-=ZnO22-+2H2O
(3)Cl-、NO3-
(4)C
(5)将pH试纸放在玻璃片上,用玻璃棒醮取待测点在试纸中间,待颜色变化稳定后与比色卡对比,读出读数
(6)Fe3+(aq) +3H2O(l)  Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1
Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1 
本题解析:(1)4Zn+10HNO3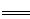 4Zn(NO3)2+N2O+5H2O,HNO3做氧化剂,但是10molHNO3里面发生化合价改变只有2mol,Zn做还原剂,所以氧化剂与还原剂的物质的量之比是1 :2。
4Zn(NO3)2+N2O+5H2O,HNO3做氧化剂,但是10molHNO3里面发生化合价改变只有2mol,Zn做还原剂,所以氧化剂与还原剂的物质的量之比是1 :2。
(2)偏铝酸钠在水溶液中都是以Na[Al(OH)4]的形式存在,以前只不过是为了方便,把它简写成NaAlO2。但它的实际组成还是Na[Al(OH)4]。 NaAlO2偏铝酸钠是简写,就像氢离子(H+)实际上是水合氢离子一样。[Zn(OH)4]-与此相类似。
(4)在一定条件下,难溶强电解质AmBn溶于水形成饱和溶液时,溶质的离子与该固态物质之间建立动态平衡,叫作沉淀溶解平衡。这时,离子浓度的乘积为一常数,叫作溶度积,用Ksp表示。很明显,滤液E的pH=4时,Zn(OH)2已经溶解,所以无法求得溶度积,而Fe(OH)3是已沉淀形式存在,所以可以求得。
(6)由②×3-①即可得到Fe3+(aq) +3H2O(l)  Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1 。
Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1 。
Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-) KW=c(OH-)·c(H+)
Fe3+发生水解反应的平衡常数:K=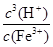 =
=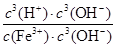 =
=
考点:考查化学综合运用。
本题难度:困难
3、选择题 T℃时,N2与H2反应生成NH3,其能量变化如图(I)所示.若保持其他条件不变,温度分别为T1℃和T2℃时,H2的体积分数与时间的关系如图(Ⅱ)所示.则下列结论正确的是( ? )
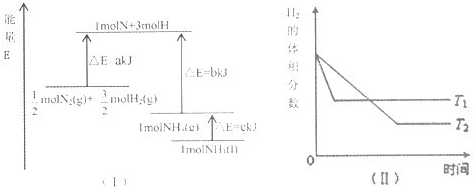
A.该反应的热化学方程式是:
1/2N2(g)+3/2H2(g)?NH3(g)△H=-(a+b)kJ?mol-1
B.该反应的热化学方程式:N2(g)+3H2(g)?2NH3(l)△H=-2(b+c-a)kJ?mol-1
C.T1<T2,且正反应为放热反应
D.其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大
参考答案:B
本题解析:
本题难度:简单
4、选择题 已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)=CO2(g);△H=-393.51kJ?mol-1
C(金刚石)+O2(g)=CO2(g);△H=-395.41kJ?mol-1”,则下列结论正确的是( )
A.在该条件下金刚石比石墨稳定,等质量时金刚石的能量大于石墨
B.金刚石转化为石墨为放热反应
C.石墨转化为金刚石为物理变化
D.由于石墨转化为金刚石为吸热反应,因此石墨在任何条件下都不可能转化为金刚石
参考答案:B
本题解析:
本题难度:简单
5、填空题 (10分)现在城市居民使用的管道煤气的主要成分是H2、CO和少量CH4。H2、CO和CH4的燃烧热数据如下表
物质
| H2
| CO
| CH4
|
燃烧热kJ?mol-1
| 285.8
| 283.0
| 890.3
|
(1)请写出H2、CO和CH4燃烧的热化学方程式。
; ; 。
(2)作为开发西部的西气东输工程的重要成就,西部天然气已全面进入上海、江苏境内,使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大_____(填“空气”或“天然气”)的进入量或减少_____(填“空气”或“天然气”)的进入量。据报道,同时燃气价格也将在现有的0.95元/m3的基础上调整到1.31元/m3,请通过计算说明若居民保持生活水平不变,在消耗燃气方面的消费大约是现在的____倍。(精确到小数点后2位)
参考答案:(1) H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8KJ/mol;CO(g)+ 1/2O2(g)= CO2(g) ΔH=-283.0KJ/mol ;CH4(g)+2O2(g)= CO2(g)+2H2O(l) ΔH=-890.3KJ/mol ;(2)空气、天然气;0.44.
本题解析:(1)根据表格中物质的燃烧热的数值可知:H2、CO和CH4燃烧的热化学方程式是(1) H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8KJ/mol;CO(g)+ 1/2O2(g)= CO2(g) ΔH=-283.0KJ/mol ;CH4(g)+2O2(g)= CO2(g)+2H2O(l) ΔH=-890.3KJ/mol ;(2)作为开发西部的西气东输工程的重要成就,西部天然气已全面进入上海、江苏境内,使用管道煤气用户改用天然气,由于单位体积的天然气消耗的氧气量大,所以应调整灶具进气量阀门,即增大空气的进入量或减少天然气的进入量。据报道,同时燃气价格也将在现有的0.95元/m3的基础上调整到1.31元/m3,由于1mol的管道煤气燃烧放出热量是(283.0+285.8)KJ÷2=284.4KJ;1mol的天然气放出热量是890.3KJ,所以若居民保持生活水平不变,即消耗的能量不变,因此需要消耗天然气的物质的量的煤气的284.4KJ÷890.3KJ=0.32倍,原来消耗1m3,花费0.95元,则消耗的天然气的体积是0.32m3,需要花费:0.32m3×1.31元/m3=0.42元,所以在消耗燃气方面的消费大约是现在的倍数关系是:0.42元÷0.95元=0.44(倍),故更经济。
考点:考查燃烧热的热化学方程式的书写、燃烧不同燃料的灶具的改造方法、花费大小的比较的计算。
本题难度:一般