微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向含有Fe3+、Fe2+、Mg2+、NH4+的水溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,上述离子数目没有明显变化的是( )
A.Fe2+
B.NH4+
C.Fe3+
D.Mg2+
参考答案:A、加入Na2O2固体,会把?Fe2+被氧化成Fe3,故A错误;
B、足量过氧化钠溶于水,产生大量氢氧根离子,NH4+与氢氧根生成氨水,氨水分解产生氨气,导致铵离子减少,故B错误;
C、由于Fe2+被氧化成了Fe3,使得Fe3+增加了,故C错误;
D、在整个的反应过程中,Mg2+?数目没有变化,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 对溶液中的离子反应存在下列几种说法,其中正确的是?
A.不可能是氧化还原反应
B.只能是复分解反应
C.可能是化合反应
D.不可能是置换反应
参考答案:C
本题解析:溶液中的离子反应与氧化还原反应和非氧化还原反应存在相交关系,也与四种基本反应类型存在相交关系。
本题难度:一般
3、计算题 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出FeCl3、AlCl3的物质的量浓度各为多少?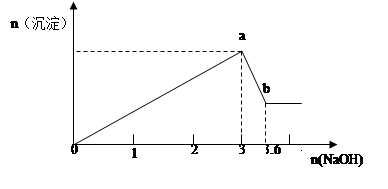
参考答案:FeCl3、AlCl3的物质的量浓度各为4mol/L、6mol/L(要写出规范的计算过程)
本题解析:由Fe3+ + 3OH- = Fe(OH)3↓? Al3+ + 3OH- =Al(OH)3↓得当所有Fe3+和 Al3+都沉淀完全时,,达到最大沉淀量a,消耗OH-3mol,即FeCl3、AlCl3共1mol
继续加NaOH,Al(OH)3逐渐溶解,Al(OH)3 + OH- =AlO2- +H2O
消耗OH-共0.6mol。所以可以由原子守恒得出AlCl3的物质的量为0.6mol,所以FeCl3物质的量为0.4mol。
c(FeCl3)=n/V=0.4mol/0.1L=4mol/L,c(AlCl3)=n/V=0.6mol/0.1L=6mol/L。
点评:在此总结一下对于图象问题的分析方法:(1)认清坐标系,搞清纵、横坐标所代表的意义。(2)看清起点、拐点、终点,看清曲线的变化趋势,并弄清楚各点的物理意义。
本题难度:一般
4、选择题 下列物质中属于非电解质的是:
A.氯化钾的水溶液
B.液态氯化氢
C.气态甲烷
D.作电极的碳棒
参考答案:C
本题解析:A错误,氯化钾的水溶液是混合物,不属于电解质,也不属于非电解质。
B错误,氯化氢是电解质。
C正确,属于非电解质。
D错误,碳棒是单质,不属于电解质,也不属于非电解质。所以正确答案选C。
本题难度:一般
5、选择题 下列离子方程式中正确的是
A.向KAl(SO4)2溶液中加入Ba(OH)2至SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-→2BaSO4↓+AlO2-+2H2O
B.用硫酸铜溶液吸收硫化氢气体:Cu2++S2-→CuS↓
C.过量的Al2(SO4)3溶液加入NaAlO2溶液中:Al3++3AlO2-+6H2O→4Al(OH)3↓
D.向NaHCO3溶液中加入过量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-→BaCO3↓+CO32-+2H2O
参考答案:AC
本题解析:分析:A、KAl(SO4)2和Ba(OH)2反应生成硫酸钡和偏铝酸根;
B、硫化氢气体不能生成离子形式;
C、铝离子和偏铝酸根反应生成了氢氧化铝沉淀;
D、氢氧化钡过量,溶液中不会存在碳酸根离子.
解答:A、KAl(SO4)2和Ba(OH)2反应的离子方程式是:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故A正确;
B、硫化氢不能拆开,写成分子形式,正确离子方程式为:Cu2++H2S═CuS↓+2H+,故B错误;
C、Al2(SO4)3和NaAlO2反应的离子方程式是:Al3++3AlO2-+6H2O═4Al(OH)3↓,故C正确;
D、由于氢氧化钡过量,反应生成的碳酸根完全生成了碳酸钡沉淀,反应的离子方程式是:Ba2++HCO3-+OH-═BaCO3↓+2H2O,故D错误;
故选AC.
点评:本题考查了离子方程式的书写,是高考的热点,注意反应物的量对离子方程式的影响,本题难度中等.
本题难度:困难