微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关AgCl沉淀的溶解平衡的说法中,正确的是( )
A.AgCl沉淀生成和溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl的溶解度减小
D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变
参考答案:A
本题解析:AgCl固体在溶液中存在溶解平衡,当达到溶解平衡时,AgCl固体生成Ag+和Cl-的速率必然等于Ag+和Cl-结合成AgCl固体的速率,A正确;没有绝对不溶的物质,B错误;一般说来,温度升高,固体的溶解度增大,C错误,但少数固体的溶解度随温度升高而降低,如Ca(OH)2;向AgCl沉淀的溶解平衡体系中加入NaCl固体,增大了c(Cl-),平衡向左移动,AgCl的溶解度减小,D错误。
本题难度:一般
2、选择题 已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如图(饱和Ag2SO4溶液中c(Ag+) =0. 034mol/L)。若t1时刻在上述体系中加入100mL 0.020mol/L Na2SO4溶液,下选项中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是
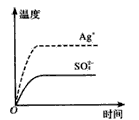
[? ]
A.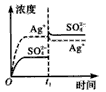
B.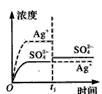
C.
D.
参考答案:B
本题解析:
本题难度:一般
3、选择题 已知:(1) CuS04十 Na2C03
主要 : Cu2+ + C032- + H20 ="=" Cu(OH)2 ↓十 CO2 ↑
次要 : Cu2+ + C032- ="=" CuC03↓
(2) CuS04 + Na2S
主要 : Cu2+ + S2- ="=" CuS ↓
次要 : Cu2+ + S2- + 2H20 ="=" Cu(OH)2↓+ H2S ↑
下列几种物质的溶解度大小的比较中,正确的是
A.CuS <Cu(OH)2<CuC03
B.CuS >Cu(OH)2>CuC03
C.Cu(OH)2>CuC03>CuS
D.Cu(OH)2<CuC03<CuS
参考答案:A
本题解析:物质的转化一般是向生成更难溶的方向转化,所以根据反应式可判断,选项A是正确的。
本题难度:一般
4、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列说法正确的是

A.CaSO4在稀硫酸中的溶解性与在纯水中的溶解性相同
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp
参考答案:
本题解析:稀硫酸中c(SO42-)大,抑制溶解,A不正确。B点溶液中离子积大于9×10-6,所以一定有沉淀析出。由于起始时c(SO42-)小于c(Ca2+),所以平衡时c(SO42-)仍然小于c(Ca2+),即c(SO42-)小于3×10-3 mol/L,C不正确。蒸发过程中c(SO42-)应该是增大的,所以选项C不正确。溶度积常数只与温度有关系,所以选项D正确,答案选D。
本题难度:一般
5、选择题 海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
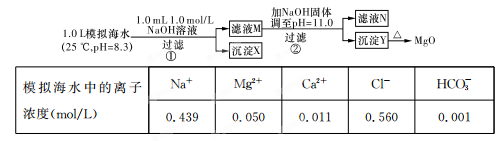
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。已知:KSp(CaCO3)=4.96×10-9;KSp(MgCO3)=6.82×10-6;KSp[Ca(OH)2]=4.68×10-6;KSp[Mg(OH)2]="5.61×10" -12。
下列说法不正确的是
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+和Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y只有Mg(OH)2
参考答案:C
本题解析:步骤①,从题给的条件,可知n(NaOH)=0.001mol,[即n(OH-)=0.001mol].依据离子反应“先中和、后沉淀、再其他”的反应规律,当1L模拟海水中,加入0.001mol NaOH时,OH- 恰好与HCO3-完全反应:OH-+HCO3-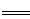 CO32-+H2O,生成0.001molCO32-.由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3沉淀Ca2++CO32-=CaCO3↓.所以沉淀物X为CaCO3,故A正确;步骤①中,由于CO32-只有0.001mol,反应生成CaCO3所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010mol·L-1,所以滤液M中同时存在着Ca2+和Mg2+,故B正确;步骤②,当滤液M中加入NaOH 固体,调至pH=11时,此时滤液中c(OH-)=1×10-3 mol·L-1.则Q[Ca(OH)2]=c(Ca2+)×(10-3)2=0.010×(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成,Q[Mg(OH)2]=c(Mg2+)×(10-3)2=0.050×(10-3)2=5×10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成,又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6<10-5,无剩余,滤液N中不存在Mg2+,故C错误;步骤②中若改为加入4.2 g NaOH固体,则n(NaOH)=0.105mol,与0.05mol Mg2+反应:Mg2++2OH-=Mg(OH)2↓,生成0.05 molMg(OH)2,剩余0.005 mol OH-,由于Q[Ca(OH)2]=c(Ca2+)×(OH-)2=0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],所以无Ca(OH)2沉淀析出,沉淀物Y为Mg(OH)2沉淀,故D正确。sp的应用和计算,离子反应等。
CO32-+H2O,生成0.001molCO32-.由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3沉淀Ca2++CO32-=CaCO3↓.所以沉淀物X为CaCO3,故A正确;步骤①中,由于CO32-只有0.001mol,反应生成CaCO3所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010mol·L-1,所以滤液M中同时存在着Ca2+和Mg2+,故B正确;步骤②,当滤液M中加入NaOH 固体,调至pH=11时,此时滤液中c(OH-)=1×10-3 mol·L-1.则Q[Ca(OH)2]=c(Ca2+)×(10-3)2=0.010×(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成,Q[Mg(OH)2]=c(Mg2+)×(10-3)2=0.050×(10-3)2=5×10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成,又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6<10-5,无剩余,滤液N中不存在Mg2+,故C错误;步骤②中若改为加入4.2 g NaOH固体,则n(NaOH)=0.105mol,与0.05mol Mg2+反应:Mg2++2OH-=Mg(OH)2↓,生成0.05 molMg(OH)2,剩余0.005 mol OH-,由于Q[Ca(OH)2]=c(Ca2+)×(OH-)2=0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],所以无Ca(OH)2沉淀析出,沉淀物Y为Mg(OH)2沉淀,故D正确。sp的应用和计算,离子反应等。
本题难度:一般