微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 “绿色化学”要求在化工合成过程中,目标产物对反应物的原子利用率达到100%,下列反应类型最符合这一要求的是
[? ]
A.取代反应
B.加成反应
C.氧化反应
D.置换反应
2、计算题 (10分)硝酸是一种重要的 化工原料,工业上生产硝酸的主要过程如下:
化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入ImolN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的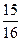 ,则N2的转化率
,则N2的转化率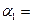 ?;若容器压强恒定,达到平衡状态时,N=的转化率为
?;若容器压强恒定,达到平衡状态时,N=的转化率为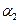 ,则
,则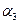 ?
?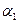 (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O? 4NO+3O2+2H2O=4HNO3
4NO+6H2O? 4NO+3O2+2H2O=4HNO3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为?
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+Na2CO3=2NaNO2+CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1. 0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)?
0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)?
3、填空题 (13分)以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4===TiOSO4+FeSO4+2H2O
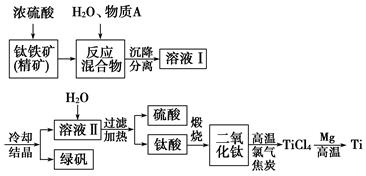
回答下列问题:
(1)钛铁矿和浓硫酸反应属于________(选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是
_________________________,?
(3)反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是__________________
2MgCl2+Ti在Ar气氛中进行的理由是__________________
________________________________________________________________________。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH1=-72 kJ·mol-1
TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g) ΔH2=38.8 kJ·mol-1
C(s)+CO2(g)===2CO(g) ΔH3=282.8 kJ·mol-1
反应C(s)+O2(g)===CO2(g)的ΔH=________。
4、填空题 (12分)硫酸被人们誉为“化学工业之母”,在国民生产中发挥着重要作用,硫酸的产量是衡量一个国家化学工业水平的标志。工业上生产硫酸包括三步:
(1)第一步,在沸腾炉中煅烧黄铁矿,反应如下:4FeS2+11O2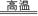 8SO2+2Fe2O3,该反应的氧化产物是?,当生成8 mol SO2时转移电子的物质的量为?。
8SO2+2Fe2O3,该反应的氧化产物是?,当生成8 mol SO2时转移电子的物质的量为?。
(2)第二步,在接触室中发生如下反应:2SO2+O2  ?2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2, 反应达平衡后测得SO2的转化率为α2,则α1?α2(填“大于”、“等于”或“小于”)。
?2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2, 反应达平衡后测得SO2的转化率为α2,则α1?α2(填“大于”、“等于”或“小于”)。
(3)第三步,在吸收塔中将SO3转化成硫酸。硫酸是化学实验中的常用试剂:
①浓硫酸可以与多种物质发生化学反应,试写出浓硫酸与铜发生反应的化学方程式?。
②有Na、Mg、Al、Cu四种金属,若两两混合后取混合物14 g与足量稀硫酸反应,产生标准状况下H25.6 L,则此混和物的组合方式最多有?种。
5、选择题 绿色化学提倡化工生产应提高原子利用率.原子利用率表示目标产物的质量与生成物总质量之比.在下列氮肥的制备反应中,原子利用率不是100%是( )
A.NH3+H2O+CO2=NH4HCO3
B.2NH3+CO
H2O+CO(NH2)2
C.NH3+HNO3=NH4NO3
D.NH3+HCl=NH4Cl