微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是_______。
②若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:

1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
T / ℃
| 165
| 175
| 185
| 195
|
K
| 111.9
| 74.1
| 50.6
| 34.8
|
①焓变ΔH(填“>”、“<”或“=”)_______0。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)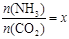 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______。
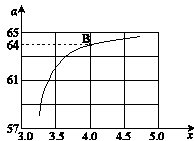
③上图中的B点处,NH3的平衡转化率为_______。
参考答案:(1)①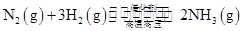 ?
?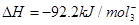 ?
?
② <?③391
(2)① <?②c(NH3)增大,平衡正向移动?③32%
本题解析:(1)合成氨工业中每产生2 mol NH3,放出92.2 kJ热量。根据定量关系可以得到①工业合成氨的热化学方程式是①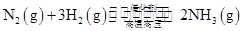 ?
?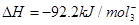 ;由于该反应是可逆反应所以2 mol N2和6 mol H2完全反应理论上可以放出184.4 kJ热量,但是实际中得到的只能比184.4 kJ少所以②若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q<184.4 kJ。
;由于该反应是可逆反应所以2 mol N2和6 mol H2完全反应理论上可以放出184.4 kJ热量,但是实际中得到的只能比184.4 kJ少所以②若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q<184.4 kJ。
③已知:
 ?
?
所以由反应热的计算公式可得6 mol N-H键能—(1 mol N-N键能+3 mol H-H键能)=92.2kj
所以1 mol N-H键断裂吸收的能量约等于391kJ。
(2)由该反应的平衡常数和温度关系
T / ℃
165
175
185
195
K
111.9
74.1
50.6
34.8
?
可以看到温度越高,平衡向吸热方向移动,K越小,平衡向逆反应方向移动,即逆反应方向就是吸热方向所以正反应方向为放热反应,所以①焓变ΔH<0。
② 2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)增加NH3的浓度,平衡会向正反应方向移动,所以CO2平衡转化率会增大?
CO(NH2)2 (l) + H2O (l)增加NH3的浓度,平衡会向正反应方向移动,所以CO2平衡转化率会增大?
2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)
CO(NH2)2 (l) + H2O (l)
起始量物质的量:? 4x? x? 0? 0
变化量物质的量:? 2y? y? y? y
平衡量物质的量:? 4x-2y? x-y? y? y
CO2平衡转化率a=y/x=64%?
所以③上图中的B点处,NH3的平衡转化率=2y/4x=32%
点评:会用化学键计算反应热,会用三行式进行化学平衡的计算,能熟练运用化学平衡常数和温度的变化分析正逆反应的吸放热情况。“三行式”即:第一行表示的是物质开始反应的量,第二行表示的是物质反应的量,第三行表示的是物质反应后的量。
本题难度:一般
2、选择题 根据下列热化学方程式
(1)C(s) + O2(g) = CO2(g)? △H1=–393.5 kJ/mol
(2)H2(g) + 1/2O2(g) =H2O(l)? △H2=–285.8 kJ/mol
(3)CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l)? △H3=–870.3kJ/mol
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
A.△H = 244.1kJ/mol
B.△H =-488.3kJ/mol
C.△H = -996.6kJ/mol
D.△H= 996.6kJ/mol
参考答案:B
本题解析:根据盖斯定律可知,(1)×2+(2)×2-(3)即得到反应2C(s) + 2H2(g)+ O2(g)=CH3COOH(l),所以该反应的反应热△H=-393.5 kJ/mol×2-285.8 kJ/mol×2+870.3kJ/mol=-488.3kJ/mol,答案选B。
点评:该题是高考中的重要考点和题型,属于高考中的热点和高频点。该题基础性强,难易适中,有利于培养学生的逻辑思维能力和灵活应变能力,有助于提高学生的应试能力。
本题难度:简单
3、选择题 下列有关能量转化的认识不正确的是
A.植物的光合作用使太阳能转化为化学能
B.人类使用照明设备主要是将电能转化为光能
C.燃料燃烧时只是将化学能转化为热能
D.生物体内的化学变化过程在能量上比在体外发生的一些能量转化更合理、有效
参考答案:C
本题解析:植物通过光合作用合成葡萄糖,从而将太阳能转化为化学能,A正确;B、D正确,C不正确,燃料燃烧时也会发光,化学能也转化为光能,答案选C。
点评:该题是基础性试题的考查,试题贴近生活实际,有利于调动学生的学习兴趣,激发学生的学习积极性,难度不大。
本题难度:简单
4、选择题 一种化学冰袋中含有Na2SO4?10H2O(96g)、NH4NO3(50g)、(NH4)2SO4(40g)、NaHSO4(40g).将
Na2SO4?10H2O和其他三种盐分别盛于两只塑料袋中,使用时把它们混合并用手揉搓就可制冷,制冷效果能维持2~3h.以下关于制冷原因的猜测肯定错误的是( )
A.Na2SO4?10H2O脱水是吸热过程
B.较长时间制冷是由于Na2SO4?10H2O脱水过程较慢
C.铵盐发生了复分解反应,且为吸热反应
D.NH4NO3溶于水会吸收热量
参考答案:A、Na2SO4?10H2O脱水是吸热过程,故A正确;
B、因为十水硫酸钠脱水较慢,它一点点地脱水,水遇上硝酸铵吸热,因此制冷效果可以维持较长,故B正确;
C、铵盐不会自身发生复分解反应,而又不具备与Na2SO4?10H2O发生复分解反应的条件,故C错误;
D、硝酸铵溶解吸热,故D正确;
故选C.
本题解析:
本题难度:简单
5、选择题 现在电视上有一“自热米饭”的广告播的很火,它介绍在食用时,将一无色液体加入到一白色固体中,放上装米饭的盒子,过几分钟米饭马上就热气腾腾,就可以食用了,非常方便。请你推测其白色固体和无色液体可能是如下哪个组合?(?)?
A.硝酸铵和水
B.浓硫酸和水
C.氧化钙和水
D.固体酒精和水
参考答案:C
本题解析:略
本题难度:简单