微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
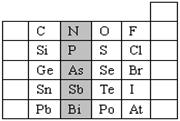
(1)阴影部分元素N的最高价氧化物为 。根据元素周期律,请你预测:H3AsO4、H3PO4 的酸性强弱:
H3AsO4?H3PO4。(用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为?、?,
(3)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构。请写出羰基硫分子的电子式?
(4)单质砷和热的浓H2SO4反应,生成As2O3,反应的化学方程式为_________ ;
参考答案:(8分)(1)N2O5? <?(2)+6? -2 (3)
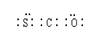
(4) 2As+3H2SO4(浓) ?As2O3+3SO2↑+3H2O
?As2O3+3SO2↑+3H2O
本题解析:⑴阴影部分为第ⅤA元素,最高价为+5,由上到下非金属性逐渐减弱,最高价含氧
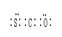
酸酸性减弱,因此N的最高价氧化物为N2O5,H3AsO4<H3PO4。
⑵S为第ⅥA,S的最高正价和最低负价分别为+6、-2,
⑶二氧化碳分子结构为直线型,碳与每个氧形成两对电子对,则羰基硫分子的电子式为
⑷单质砷和热的浓H2SO4反应,生成As2O3,则H2SO4被还原为SO2,
反应式为2As+3H2SO4(浓) ?As2O3+3SO2↑+3H2O
?As2O3+3SO2↑+3H2O
本题难度:一般
2、选择题 下列说法正确的是 ?( )
A.原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似
B.Fe3+的最外层电子排布式为:3s23p63d5
C.硫离子的结构示意图为: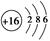
D.基态碳原子的电子排布图:
参考答案:B
本题解析:A项:最外层电子数不同,化学性质也不同,故错;C项:最外层应是8个电子,故错;D项:2s先排2个,再排2p,故错。故选B。
点评:题考查的是原子核外电子数排布的知识,题目难度适中,注重基础知识的学习。
本题难度:一般
3、选择题 短周期主族元素A、B、C、D原子序数依次增大。A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是?
A.原子半径:A<B<C<D? B.C单质在常温下为气态
C.D单质在工业上的用途之一是制漂白粉? D.B的氧化物为碱性氧化物
参考答案:C
本题解析:依题意可知A为氧B为铝C为硫D为氯,原子半径:B>C>D >A,C单质在常温下为固态,B的氧化物为两性氧化物。
本题难度:一般
4、选择题 下列元素中不属于主族元素的是(?)
A.磷
B.铁
C.氟
D.氢
参考答案:B
本题解析:铁是第Ⅷ族元素,不是主族元素,其余选项均是主族元素,答案选B。
点评:该题是基础性试题的考查,难度不大。该题的关键是熟练掌握元素周期表的结构,特别是元素周期表的编制原则。
本题难度:简单
5、选择题 下列物质性质的变化规律,与共价键的键能大小有关的是(? )
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高?
②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石的硬度、熔点、沸点都高于晶体硅?
④NaF、NaCl、NaBr、NaI的熔点依次降低
A.仅②
B.仅③
C.②③
D.①②③
参考答案:C
本题解析:F2、Cl2、Br2、I2属于分子晶体,影响熔沸点的因素是分子间作用力的大小,物质的相对分子质量越大,分子间作用力越强,沸点越高,与共价键无关系,①不符合题意;HF、HI、HBr、HCl属于分子晶体,其稳定性和非金属性强弱有关系,即和形成的共价键有关系,②符合题意;金刚石、晶体硅属于原子晶体,原子之间存在共价键,原子半径越小,键能越大,熔沸点越高,与分子间作用力无关,故③符合题意;NaF、NaCl、NaBr、NaI属于离子晶体,离子半径越大,键能越小,熔沸点越低,④不符合题意,答案选C。
点评:该题是高考中的常见题型,属于中等难度试题的考查。试题针对性强,贴近高考,有利于调动学生的学习兴趣,激发学生的学习求知欲。答题注意晶体的类型以及影响晶体熔沸点高低的因素的判断,有利于培养学生的逻辑推理能力和抽象思维能力。
本题难度:一般