微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+ 2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是
(3)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为
(4)某化学小组在实验中用浓硝酸和铜反应制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧,其实验装置图如下:
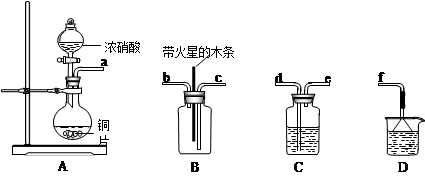
①按气流方向连接各仪器接口,顺序为a→______→______→______→______→f。
②已知二氧化氮和碳反应生成两种物质的量比为1:1的有毒气体,则该反应的化学方程式为:___________________________。
参考答案:
(1)bd (2)Cu2S(1分);4;氢气(1分)
(3)做电解质溶液,形成原电池。(4)①d→e→c→b(2分);
②NO2+C CO+NO(2分)
CO+NO(2分)
本题解析:(1)非常活泼的金属冶炼方法选择电解法,高中阶段需要掌握的钠、镁、铝是通过电解法获得;所以选bd,(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+ 2H2O,Cu2S中铜元素+1价,硫元素-2价,CuSO4中铜元素+2价,硫元素-6价,化合价升高被氧化,做还原剂,氧气做氧化剂,得失电子守恒,1摩尔氧气化合价由0价降到-2价,化合价共降低4,所以还原剂此时失电子的物质的量为4摩尔,CuSO4溶液显酸性,镁和氢离子反应生成氢气。3)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,是利用原电池原理,用铝置换出银,食盐水的作用为做电解质溶液,形成原电池。(4)某化学小组在实验中用浓硝酸和铜反应制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧,首先反应制的二氧化氮,其中混有水蒸气,用浓硫酸干燥,然后再检验,导气管均为长进短出,最后用氢氧化钠吸收多余的二氧化氮,防止污染环境。
考点:考查金属的冶炼、氧化还原反应、原电池的应用、实验装置
本题难度:困难
2、填空题 燃料电池是使气体燃料氧化直接产生电流的装置,燃料电池的研究是本世纪最具挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入丁烷,电池的电解质是掺杂了Y2O3(三氧化二钇)的ZrO2(二氧化锆)晶体,它在高温下能传导O2-。试回答下列问题:
(1)该电池放电时的化学反应方程式为:__________________________。
(2)该燃料电池的电极反应式为:正极:13O2+52e-→26O2-负极:2C4H10+26O2--52e-→8CO2+10H2O 则固体电解质中的O2-向________极移动(填“正”或“负”)。
(3)某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出3360 mL(标准状况)氧气,阴极析出金属10.4 g,在该含氧酸盐中金属的化合价为________,在该实验中,若不考虑能量的损失,电池中消耗丁烷的质量最少是________g(结果精确至0.01 g)。
参考答案:(1)2C4H10+13O2==8CO2+10H2O
(2)负
(3)+3;1.34
本题解析:
本题难度:一般
3、填空题 A、B、C三个烧杯中分别盛有相同物质的量浓度的硫酸铜溶液.D为电解池,其中电极材料均为惰性物质,通过导线与直流电源相连.实验开始时,同时在XY两边各滴入几滴酚酞试液,X极附近首先变红.
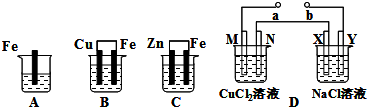
请回答以下问题:
(1)B中Cu极电极反应式为______.
(2)A、B、C三个烧杯中Fe的反应速率最快的是______.
(3)若C中被腐蚀金属的质量是32.5g,则反应中转移的电子的物质的量是______.
(4)D中直流电源a为______极.
(5)电池D中N极上的电极反应式为:______.
(6)D中在M、N、X、Y各电极上析出生成物的物质的量之比为______.
参考答案:A是金属铁直接和硫酸铜之间的反应,B是原电池,金属铁为负极,金属铜为正极,C为原电池,金属锌是负极,金属铁是正极,D中在XY两边各滴入几滴酚酞试液,X极附近首先变红,说明X附近是氢离子放电了,所以X极是阴极,所以Y极是阳极,b极是电源的正极,a极是电源的负极,M极是阴极,N是阳极.
(1)B中Cu极为正极,发生铜离子得电子的还原反应,电极反应式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(2)金属的腐蚀速率:原电池的负极腐蚀速率>化学腐蚀>原电池的正极腐蚀速率,即反应速率最快的是B,故答案为:B;
(3)C中负极反应是:Zn-2e-→Zn2+,被腐蚀金属锌的质量是32.5g即0.5mol时,转移电子数是1mol,故答案为:1mol;
(4)M极是阴极,a极是电源的负极,故答案为:负;
(5)电池D中N极是阳极,氯离子发生失电子的氧化反应,电极反应式为:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(6)D中在M、N、X、Y各电极上的电极反应分别为:M、Cu2++2e-→Cu,N、2Cl-→Cl2↑+2e-,X、2Cl-→Cl2↑+2e-,Y、2H++2e-→H2↑,当转移电子的物质的量相等时,生成物的物质的量也相等,所以生成物的物质的量之比为1:1:1:1,故答案为:1:1:1:1.
本题解析:
本题难度:一般
4、选择题 某原电池总反应为2Fe3++Fe=3Fe2+,不能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为FeCl3
B.正极为C,负极为Fe,电解质溶液为Fe(NO)3
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3
D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3
参考答案:C
本题解析:
本题难度:简单
5、选择题 将X、Y连接后插入Z的溶液中构成原电池,一段时间后X变细,Y上有气泡产生,则X、Y、Z 可能分别是(?)
A.Cu 、 Al 、CuSO4
B.Cu 、Ag 、AgNO3
C.Fe 、C、H2SO4
D.Cu 、C、HCl
参考答案:C
本题解析:题中X变细,Y上有气泡产生,说明X做负极,Y做正极,所以金属活泼性:X>Y,排除A选项;B选项中能构成原电池,但是正极上没有气体产生,故排除;C选项中Fe做负极,故反应一段时间后Fe变细,C做正极,电解质溶液是H2SO4,故C上有H2产生;D选项中的材料不能自发的构成氧化还原反应,故没有构成原电池
本题难度:简单