微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用石墨作电极,电解CuSO4溶液,一段时间后,阴极上只析出铜,要恢复到原浓度,应向溶液中加入
A.Cu(OH) 2
B.Cu
C.CuSO4
D.CuO
参考答案:D
本题解析:电解什么物质加入什么物质,电解CuSO4溶液析出铜产生氧气,加入氧化铜。
本题难度:简单
2、选择题 将1molSO2和1molO2通入一体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,SO3为0.3mol。此时若移走0.5molO2和0.5molSO2,则反应达到新的平衡时,SO3的物质的量为
A.0.3 mol
B.0.15 mol
C.大于0.15mol,小于0.3mol
D.小于0.15mol
参考答案:D
本题解析:试题分析:再加1mol SO2和1molO2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;反应物转化率增大。
用极限法求出n(SO3)的范围,假设反应物转化率与原平衡相同,此时n(SO3)=0.3mol×2=0.6mol,假设2molSO2完全生成SO3,根据化学方程式2SO2+O2 ?2SO3,可知n(SO3)=2mol,所以再次达到平衡时,0.6mol<n(SO3)<2mol。
?2SO3,可知n(SO3)=2mol,所以再次达到平衡时,0.6mol<n(SO3)<2mol。
故选D。
考点:化学平衡建立的过程
点评:题考查化学平衡影响因素等,关键在于根据平衡移动,判断反应物转化率增大,应加强平时知识的积累。
本题难度:困难
3、选择题 下列物质中属于强电解质的是
A.NH3·H2O
B.H2O
C.CH3COOH
D.醋酸铵
参考答案:D
本题解析:醋酸铵,CH3COONH4 ?在水中完全电离出铵根与醋酸根,故为强电解质。醋酸为弱电解质,水为非电解质。答案选D。
本题难度:一般
4、选择题 下列反应中必须加入氧化剂才能实现的是
A.Cl2→Cl-
B.Zn→ Zn2+
C.H2→H2O
D.CuO→CuCl2
参考答案:BC
本题解析:氧化剂在化学反应中化合价降低,发生还原反应;那么选项中提供的反应物要做还原剂,据此可以判断Zn→ Zn2+和H2→H2O的反应中均需要加入还原剂才能实现,而Cl2→Cl-需加入还原剂才能实现,CuO→CuCl2不属于氧化还原反应。
本题难度:困难
5、填空题 (1)只用一种试剂即可除去少量杂质和鉴别物质。将其填在空格处。
编号
| 物质
| 试剂名称或化学式
|
①
| 除杂质:NaHCO3溶液(Na2CO3)
|
|
②
| 除杂质:SiO2(CaCO3)
|
|
③
| 除杂质:FeCl2溶液(FeCl3)
|
|
④
| 鉴别:Na2CO3 Na2SiO3 Na2SO3溶液
|
|
⑤
| 鉴别:(NH4)2SO4 NH4C1 Na2SO4溶液
|
|
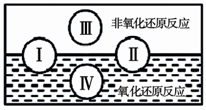
(2)氧化还原是常见的反应类型,根据信息回答以下问题: “四种基本反应类型与氧化还原反应的关系”也可用下图表达。其 中Ⅰ为化合反应,则Ⅱ为 反应。写出一个有水生成的符合反应类型Ⅲ的化学方程式: 。写出一个有水参加的符合反应类型Ⅳ的化学方程式 ,其中水作为 剂。(填氧化剂、还原剂等)
(3)将SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,溶液不褪色。经实验证明,SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是 。
参考答案:(1)①二氧化碳 ②盐酸 ③ 铁屑 ④ 盐酸 ⑤ 氢氧化钡溶液
(2)分解; III方程式合理即可.IV方程式合理即可
与金属反应水为氧化剂。与氟反应水为还原剂。与氯气反应水既不是氧化剂也不是还原剂。
(3)(2分)SO2+C12+2H2O===4H++SO42-+2Cl-
本题解析:(1)①Na2CO3与CO2、H2O反应生成NaHCO3,所以加入CO2可除去杂质Na2CO3。
②盐酸与CaCO3反应生成CaCl2、CO2和H2O,所以加入盐酸可除去CaCO3。
③Fe与FeCl3反应生成FeCl2,所以加入Fe可除去FeCl3。
④加入盐酸生成无色无味气体的溶液是Na2CO3,生成无色刺激性气味气体的溶液是Na2SO3,生成白色沉淀的溶液是Na2SiO3。
⑤加入Ba(OH)2溶液,只生成白色沉淀的溶液是Na2SO4,只生成刺激性气味气体的溶液是NH4Cl,既生成白色沉淀,也生成刺激性气味气体的溶液是(NH4)2SO4.
(2) 化合反应与分解反应部分属于氧化反应,部分属于非氧化反应;类型Ⅲ为复分解反应,生成H2O的反应都可以,如酸碱中和反应:HCl+NaOH=NaCl+H2O;反应类型Ⅳ是置换反应,有H2O参加反应如:2Na+2H2O=2NaOH+H2↑,水为氧化剂。
(3)Cl2与SO2、H2O反应生成H2SO4和HCl,离子方程式为:SO2+C12+2H2O===4H++SO42-+2Cl-
考点:本题考查物质的鉴别和除杂、基本反应类型与氧化还原反应、离子方程式的书写。
本题难度:一般