微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 今有下列仪器:铁架台、铁圈、三脚架、烧杯、圆底烧瓶、漏斗、分液漏斗、滤纸、石棉网、酒精灯、玻璃棒、量筒、蒸发皿、冷凝管、火柴。从缺乏必要的仪器和用品的角度考虑,不能进行的分离操作是(? )
A.过滤
B.蒸馏
C.萃取
D.蒸发
参考答案:B
本题解析:蒸馏操作必须需要蒸馏烧瓶、冷凝管等主要仪器。
本题难度:一般
2、实验题 某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,因为加热温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。为探究X的成分,他们进行了如下实验(图中①②表示试剂的加入顺序)。
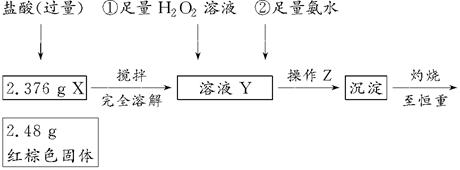
(1)操作Z是________。下列仪器中,在灼烧沉淀时必须用到的仪器名称是________;

(2)写出向溶液Y中滴加H2O2溶液时发生反应的离子方程式:________;
(3)通过以上数据,得出2.376 g黑色粉末X中各成分的物质的量为________。
参考答案:(1)过滤、洗涤(只答过滤不正确) 坩埚、泥三角
(2)2Fe2++2H++H2O2=2Fe3++2H2O
(3)n(Fe3O4)=0.01 mol,n(Fe)=0.001 mol
本题解析:因为实验的目的是测定X的成分,这是一个定量实验,故过滤后的沉淀需要洗涤,灼烧固体时可以在坩埚中进行,坩埚应放在泥三角上。因2.48 g红棕色固体肯定是Fe2O3,其物质的量为0.0155 mol,所含铁元素的质量为1.736 g,因该数值小于2.376 g,故样品中含有Fe3O4。设样品中Fe3O4为x mol,Fe为y mol,则3x+y=0.031,232x+56y=2.376,解得x=0.01、y=0.001。
本题难度:一般
3、选择题 下列实验装置和操作一般不用于分离物质的是( )
A.
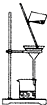
过滤
B.

定容
C.
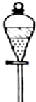
分液
D.
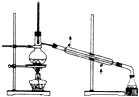
蒸馏
参考答案:B
本题解析:
本题难度:一般
4、简答题 锌钡白是一种白色颜料.工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓.以下是工业生产流程.请回答有关问题:
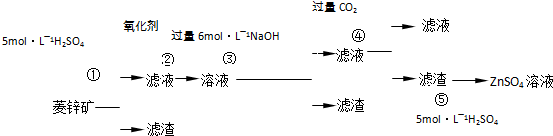
Ⅰ.ZnSO4溶液的制备与提纯有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等.
(1)②中使用的氧化剂最好是下列的______(填序号),理由是______.
?A.Cl2? B.H2O2? C.KMnO4? D.浓HNO3
(2)写出反应④的离子方程式:______.
(3)为了达到综合利用、节能减排的目的,上述流程中步骤______产生的______可以用于步骤______(其中步骤选填①、②、③、④、⑤).
Ⅱ.BaS溶液的制备
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
C(s)+-O2(g)=CO(g);△H=-110.5kJ?mol-1
Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
重晶石(BaSo4)矿粉、煤粉
BaS+CO↑BaS溶液
(4)煅烧还原的热化学方程式为:______.
(5)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)______.
Ⅲ.制取锌钡白
(6)Ⅰ中步骤⑤使用硫酸的量要适当,如果所得溶液的酸性过强,产生的后果是______.
参考答案:(1)ZnCO3,FeCO3、Cu2(OH)2CO3都能溶液足量5mol/L硫酸溶液中,生成ZnSO4,FeSO4,CuSO4,CO2,H2O;SiO2不溶于硫酸,步骤①得到滤渣为SiO2;滤液为ZnSO4,FeSO4,CuSO4,H2O;步骤②用氧化剂是氧化亚铁离子;
A、氯气做氧化剂氧化亚铁离子会引入氯离子,且氯气有毒,故A不选;
B、过氧化氢做氧化剂被还原为水,不引入新的杂质,过量的过氧化氢加热胡分解生成氧气和水,故B正确;
C、KMnO4 做氧化剂会引入K+,MnO4-,故C错误;
D、浓HNO3做氧化剂会被还原为有毒气体NO2,引入杂质离子NO3-,故D错误;
故答案为:B;不会引入新的杂质离子;
(2)偏铝酸钠溶液中通入二氧化碳气体会生成氢氧化铝沉淀,由此推断步骤④发生的反应是Na2ZnO2,NaOH和二氧化碳反应滤渣为Zn(OH)2,滤液为NaHCO3,反应的离子方程式为:ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-,故答案为:ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-;
(3)步骤④中的CO2气体来自步骤①酸浸反应放出的气体,可以节能减排,故答案为:①;CO2;④;
(4)①Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
②C(s)+12O2(g)=CO(g);△H=-110.5kJ?mol-1
③Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
依据盖斯定律②×4-③-①得到热化学方程式为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1,
故答案为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2?kJ?mol-1;
(5)经检验BaS的水溶液呈碱性说明硫离子水解的原因,反应的离子方程式为S2-+H2O?HS-+OH-,故答案为:S2-+H2O?HS-+OH-;
(6)若步骤⑤为氢氧化锌和改过了硫酸反应,所得溶液中含有硫酸锌和硫酸,与BaS反应可以制的锌钡白,同时过量硫酸和BaS反应生成有毒气体H2S污染空气,减少锌钡白的产量,
故答案为:酸性过强,与BaS溶液混合是可能产生H2S气体污染,或锌钡白的产率会降低.
本题解析:
本题难度:一般
5、选择题 m gH2和n gHe(均为气体)的下列说法中,正确的是
A.同温同压下,H2与He的体积比为m∶2n
B.同温同压下,若m=n,则H2与He的分子数之比为1∶2
C.同温同压下,同体积时,H2与He的质量比m/n>1
D.同温同压下,H2与He的密度比为1∶2
参考答案:D
本题解析:
本题难度:简单