微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (8分)为除去粗盐中的Ca2+、Mg2+、SO42—以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
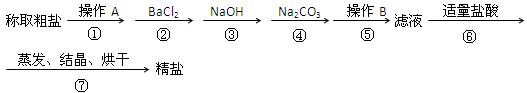
(1)第①步中,操作A是?,第⑤步中,操作B?;
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
?,?;
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是?
?。
参考答案:(8分)(1)溶解(1分)过滤(1分)(共2分)
(2)CaCl2 + Na2CO3 = CaCO3↓+2NaCl;(2分)? BaCl2 + Na2CO3 = BaCO3↓+2NaCl(2分)
(3)操作③④中生成的Mg(OH)2、CaCO3、BaCO3会与盐酸反应,从而影响制 得精盐的纯度(2分)
得精盐的纯度(2分)
本题解析:略
本题难度:一般
2、填空题 目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
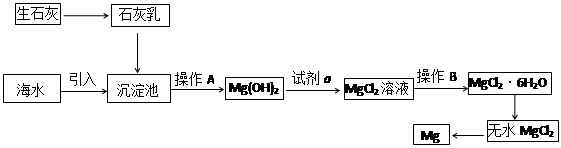
请回答下列问题:
⑴从离子反应的角度思考,在海水中加入石灰乳的作用是 ?。
⑵石灰乳是生石灰与水形成的混合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 ?。
⑶操作A是 ?, 操作B是 ?。
⑷无水MgCl2在熔融状态下,通电后会生成Mg和Cl2,该反应的化学方程式是??。从考虑成本和废物循环利用的角度,副产物氯气可以用于 ?。
⑸海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
?。
参考答案:(8分)⑴沉淀Mg2+?(或使Mg2+形成Mg(OH)2沉淀)⑵贝壳(或牡蛎壳等)?
⑶过滤 ,加热浓缩(或蒸发结晶)?
⑷MgCl2(熔融) ?Mg + Cl2↑?;制盐酸,循环使用?
?Mg + Cl2↑?;制盐酸,循环使用?
⑸海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高且成本低。
本题解析:(1)海水中含有镁离子,所以在海水中加入石灰乳的作用是沉淀Mg2+?(或使Mg2+形成Mg(OH)2沉淀)。
(2)海洋中含有大量的贝壳,而贝壳的主要成分是碳酸钙,所以生产生石灰的主要原料来源于海洋中的贝壳。
(3)氢氧化镁不溶于水,过滤即可。氯化镁易溶于水,要得到氯化镁晶体,需要加热浓缩(或蒸发结晶)。
(4)镁是活泼的金属,通过电解法冶炼,反应的化学方程式是MgCl2(熔融) ?Mg + Cl2↑。从考虑成本和废物循环利用的角度,副产物氯气可以用制盐酸,循环使用。
?Mg + Cl2↑。从考虑成本和废物循环利用的角度,副产物氯气可以用制盐酸,循环使用。
(5)由于海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高且成本低,所以要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁。
点评:该题是中等难度的试题,主要是以海水中提取镁为载体,重点考查学生对教材基础知识的了解掌握情况,意在巩固学生的基础,提高学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范实验设计能力,也有助于调动学生的学习兴趣和学习积极性。
本题难度:一般
3、选择题 某溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序正确的是
[? ]
A. Na2CO3 NaCl NaOH
B. NaOH NaCl Na2CO3
C. NaCl NaOH Na2CO3
D. NaCl Na2CO3 NaOH
参考答案:C
本题解析:
本题难度:简单
4、选择题 除去括号内杂质所用试剂和方法不正确的是( )
A.Fe?(Al)--氢氧化钠溶液,过滤
B.KNO3(NaCl)--结晶
C.水(NaCl)--蒸馏
D.淀粉(泥沙)--渗析
参考答案:A、铁中混有的铝可以和氢氧化钠反应生成偏铝酸钠和氢气,铁不反应,反应后过滤得到铁,故A正确;
B、硝酸钾溶解度随温度变化大,氯化钠溶解度随温度变化不大,可以通过结晶法除去硝酸钾中的氯化钠,故B正确;
C、食盐水中水的沸点低,利用蒸馏法使水和NaCl分离,从而除去水中的氯化钠,故C正确;
D、淀粉溶液是胶体,泥沙是浊液,渗析是利用半透膜只允许溶液通过,淀粉和泥沙都不能通过半透膜,故D错误;
故选D.
本题解析:
本题难度:简单
5、选择题 下列试剂中,可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3四种溶液的是
A.NaOH
B.H2SO4
C.NH3·H2O
D.AgNO3
参考答案:A
本题解析:加入NaOH溶液,没现象的是Na2SO4,有白色沉淀,且随着加入NaOH的量沉淀没变化的是MgCl2、白色沉淀逐渐减少的是Al2(SO4)3,沉淀由白色变为灰绿色直至红褐色的为FeCl2
本题难度:一般