微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 按要求写离子方程式,并回答有关问题。
(1)氢硫酸的电离:___________,溶液中c(H+)、c(HS-)、c(S2-)的大小关系__________。
(2)碳酸钠的水解:___________。
(3)某学生做如下实验,将盛有滴加酚酞的0.1 mol/L NaHCO3溶液的试管微热,观察到此溶液的浅红色加深,若冷却至室温时则又变回原来的颜色,为什么?(用方程式说明) 答:_____________________________。
参考答案:(1)H2S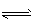 H++HS-,HS-
H++HS-,HS-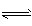 H++S2-;c(H+)>c(HS-)>c(S2-)
H++S2-;c(H+)>c(HS-)>c(S2-)
(2)CO32-+H2O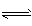 HCO3-+OH-, HCO3-+H2O
HCO3-+OH-, HCO3-+H2O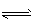 H2CO3+OH-,
H2CO3+OH-,
(3)HCO3-+H2O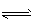 H2CO3+OH-,溶液显碱性;因为水解吸热,加热时水解平衡向右移动c(OH-)增大,溶液的浅红色加深,冷却时,水解平衡向左移动,c(OH-)减小,溶液又回到原来的颜色
H2CO3+OH-,溶液显碱性;因为水解吸热,加热时水解平衡向右移动c(OH-)增大,溶液的浅红色加深,冷却时,水解平衡向左移动,c(OH-)减小,溶液又回到原来的颜色
本题解析:
本题难度:一般
2、填空题 某二元弱酸按下式发生一级和二级电离:H2A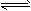 H++HA- HA-
H++HA- HA-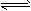 H++A2-
H++A2-
已知:相同浓度时的电离程度H2A >HA-,设有下列四种溶液:
A、0.01mol/L的H2A溶液 B、0.01mol/L的NaHA溶液
C、0.02mol/LHCl溶液与0.04mol/L的NaHA溶液等体积混合
D、0.02mol/LNaOH溶液与0.02mol/L的NaHA溶液等体积混合
据此填写下列空白(填代号):
(1)c(H+)最大的是____________;最小的是____________;
(2)c(H2A)最大的是__________;最小的是____________;
(3)c(A2-)最大的是_________;最小的是__________。
参考答案:(1)A;D
(2)C;D
(3)D;A
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是(? )?
A.氯化钠在电流作用下电离成钠离子和氯离子
B.溶于水后能电离出氢离子的化合物都是酸
C.硫酸钡难溶于水,但硫酸钡属于电解质
D.醋酸溶液中存在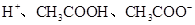 ,醋酸是强电解质
,醋酸是强电解质
参考答案:C
本题解析:氯化钠在水分子的作用下可电离成钠离子和氯离子,A错误;NaHSO4溶于水可电离出氢离子,但它属于盐,B错误;醋酸溶液中存在CH3COOH说明不能完全电离属于弱电解质,D错误。答案选C。
本题难度:简单
4、填空题 某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A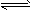 H++HA-,HA-
H++HA-,HA-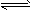 H++A2-。回答下列问题:
H++A2-。回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性” ),理由是(用离子方程式表示)
_____________________________。
(2)若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能是_______
0.11mol/L(填“>”、“=”、“<” )。理由是: _____________________________________。
(3)NaHA溶液中各离子浓度由大到小的顺序是: ______________________________。
参考答案:(1)碱性;A2-+H2O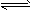 HA-+OH-?
HA-+OH-?
(2)<;0.1mo/L的H2A先完全电离产生0.1mol/L H+和0.1mol/LHA-,当0.1mol/L的HA-电离时,第一步电离产生的H+抑制了HA-的电离,使电离出的H+的浓度小于0.01mol/L,所以H+的浓度小于0.11mol/L
(3)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
本题解析:
本题难度:一般
5、选择题 下列溶液中各粒子的浓度关系不正确的是
[? ]
A.0.1?mol/L?HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1L?0.1?mol/L?CuSO4·(NH4)2SO4·6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C.0.1?mol/L?NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
参考答案:CD
本题解析:
本题难度:一般