微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式中,不正确的是
A.铁与稀盐酸反应:2Fe + 6H+  2Fe3+ + 3H2↑
2Fe3+ + 3H2↑
B.钠与水反应:2Na + 2H2O  2Na+ + 2OH- + H2↑
2Na+ + 2OH- + H2↑
C.碳酸钠与足量稀盐酸反应:CO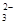 + 2H+
+ 2H+  CO2↑ + H2O
CO2↑ + H2O
D.二氧化硅与氢氧化钠溶液反应:SiO2 + 2OH- SiO32-+ H2O
SiO32-+ H2O
参考答案:A
本题解析:铁和稀硫酸的反应中生成的是硫酸亚铁和氢气,所以选项A不正确,其余选项都是正确的,大阿阿香A。
点评:归判断离子方程式正确与否的方法一般是:(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式。
本题难度:一般
2、选择题 下列离子方程式的书写正确的是
A.金属铁溶于盐酸中:2Fe+6H+=2Fe3++3H2↑
B.实验室用大理石和稀盐酸制取CO2:2H++CO32-= CO2↑+H2O
C.向AlCl3溶液中加入过量的氨水:Al3++3OH-= Al(OH)3↓
D.MnO2固体和浓盐酸反应制氯气:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
参考答案:D
本题解析:A项不符合事实,铁与盐酸反应生成的是亚铁盐;
B项大理石即CaCO3,不溶于水,不能拆
C项:氨水为弱碱,不能拆
正确选项为D
本题难度:简单
3、选择题 能用离子方程式H++OH?=H2O表示的化学反应是( )
A.氨水和稀盐酸反应
B.Ba(OH)2溶液和稀硫酸反应
C.KOH溶液和稀盐酸反应
D.KOH溶液和CO2反应
参考答案:A.因一水合氨为弱碱,在离子反应中保留化学式,不能用离子方程式H++OH?=H2O表示,故A不选;
B.因反应生成硫酸钡沉淀,在离子反应中保留化学式,不能用离子方程式H++OH?=H2O表示,故B不选;
C.KOH溶液和稀盐酸反应,为强酸与强碱反应生成可溶性盐和水的离子反应,则可用离子方程式H++OH?=H2O表示,故C选;
D.CO2在离子反应中保留化学式,不能用离子方程式H++OH?=H2O表示,故D不选;
故选C.
本题解析:
本题难度:简单
4、选择题 下列离子方程式书写正确的是
A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2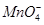 +6H++5H2O2=2Mn2++5O2↑+8H2O
+6H++5H2O2=2Mn2++5O2↑+8H2O
B.将少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O=2C6H5OH+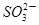
C.用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓
D.向碘化亚铁溶液中通入过量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
参考答案:B
本题解析:A. 浓盐酸有还原性,也会与酸性高锰酸钾溶液方式反应:2KMnO4+16HCl(浓) =" 2KCl+" 2MnCl2+ 5Cl2↑+8H2O,因此高锰酸钾溶液褪色不能证明是H2O2具有还原性。错误。B.酸性H2SO3>C6H5OH>HSO3-。所以将少量SO2通入苯酚钠溶液中,发生反应:2C6H5O-+SO2+H2O=2C6H5OH+SO32-。正确。C. 用硫氰化钾溶液可以检验溶液中的Fe3+:是因为发生反应Fe3++3SCN-=Fe(SCN)3Fe(SCN) 3是血红色能够溶于水的物质,不是沉淀。错误。D.I-、Fe2+都有还原性,所以向碘化亚铁溶液中通入过量的氯气,发生反应:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-.不符合客观事实。错误。
本题难度:一般
5、选择题 下表中评价合理的是
选项
| 内容
| 评价
|
A
| 一定条件下0.5mol N2和1.5molH2反应,平衡时放热akJ,则N2(g)+3H2(g)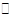 2NH3(g)? 2NH3(g)?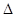 H=2akJ·mol-1 H=2akJ·mol-1
| 正确
|
B
| 氯化镁溶液与氨水反应: Mg2++2OH-=Mg(OH)2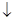
| 错误,氨水不应写成离子形式
|
C
| 向硫酸铵溶液中加入氢氧化钡溶液:
Ba2++SO42-=BaSO4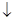
| 正确
|
D
| 等物质的量的Cl2与FeBr2在溶液中反应:
2Fe2++2Br-+2C12==2Fe3++4Cl-+Br2
| 错误,Fe2+与Br-的化学计量数之比应为l:2
|
?
参考答案:B
本题解析:A、N2与H2的反应为可逆反应,0.5mol N2部分反应,所以?H的绝对值应大于2akJ/mol,且<0,错误;B、氨水为弱碱,不能拆成离子,评价正确;C、向硫酸铵溶液中加入氢氧化钡溶液:NH4+与OH?也反应,错误;D、等物质的量的Cl2与FeBr2在溶液中反应,Cl2不足,Br?部分反应,离子方程式正确,评价错误。
本题难度:一般