微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知反应:① 2C(s)+O2(g)=2CO(g)?ΔH=-22 1 kJ/mol
1 kJ/mol
② 稀溶液中,H+(aq)+OH-(aq)=H2O(l)?ΔH=-57.3 kJ/mol
下列结论正确的是:
A.碳的燃烧热大于110.5 kJ/ mol
mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀Ba(OH)2溶液反应生成1mol水放出的热量为57.3 kJ
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量少于57.3 kJ
参考答案:AD
本题解析:略
本题难度:一般
2、填空题 Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:

(1)该合成路线对于环境保护的价值在于 。
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因 。
(3)CH3OH、H2的燃烧热分别为:△H=-725.5 kJ/mol、△H=-285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g)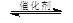 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[n(H2) / n(CO2)]
| 500 K
| 600 K
| 700 K
| 800 K
|
1.5
| 45%
| 33%
| 20%
| 12%
|
2.0
| 60%
| 43%
| 28%
| 15%
|
3.0
| 83%
| 62%
| 37%
| 22%
|
(4)该反应的焓变△H 0,熵变△S 0(填>、<或=)。
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。
(6)若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
参考答案:(1)有利于防止温室效应 (2分)
(2)HOCH2CH2NH2+H2O HOCH2CH2NH3++OH- (2分)
HOCH2CH2NH3++OH- (2分)
(3)CO2(g)+3 H2(g)= CH3 OH(l)+ H2O(l) △H=-131.9kJ/mol (3分)
(4)< (1分),< (1分)
(5) CH3 OCH3 -12e-+16 OH-=2CO32-+11 H2O (3分 )
(6)9.6(2分 )
本题解析:(1)氢气与二氧化碳合成甲醇,减少了二氧化碳的排放,有利于防止温室效应
(2)HOCH2CH2NH2水解使溶液呈碱性,发生的离子方程式为HOCH2CH2NH2+H2O HOCH2CH2NH3++OH-
HOCH2CH2NH3++OH-
(3)根据盖斯定律,将甲醇与氢气的燃烧热化学方程式作相应调整,得△H=-285.8 kJ/mol×3-(-725.5 kJ/mol)=-131.9kJ/mol,所以合成甲醇的热化学方程式为CO2(g)+3 H2(g)= CH3 OH(l)+ H2O(l) △H=-131.9kJ/mol
(4)随温度升高,二氧化碳的转化率降低,说明升温平衡向逆向移动,正反应方向为放热反应,△H<0,反应物气体的总物质的量是8mol,生成物气体的总物质的量是4mol,所以△S<0;
(5)该电池负极是甲醚发生氧化反应,碱性介质中生成碳酸根离子,电极反应式为CH3 OCH3 -12e-+16 OH-=2CO32-+11 H2O
(6)0.5min甲醚的通入量是0.025mol,转移电子是0.3mol,根据得失电子守恒,Cu2++2e-=Cu,最终得0.15mol铜,其质量是9.6g。
考点:考查化学与工业的联系,生产对环境的影响,盖斯定律对应用,化学平衡理论的应用,电化学原理的应用
本题难度:困难
3、填空题 现有浓度均为0.1 mol/L的下列溶液:
①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵
请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是____。
(3)已知T ℃,KW=1×10-13,则t ℃________(填“>”、“<”或“=”)25℃。在T℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________。
(4)25℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=________(填数据);
②若x+y=13,则a/b=________(填数据);
③若x+y>14,则a/b=________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为__(填表达式)。
参考答案:(1)④②③①
(2)c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+)
(3)> 101∶9
(4)①1 ②0.1 ③10x+y-14 ④x+y=14+lg(a/b)
本题解析:(1)向溶液中加入酸或碱均能抑制H2O的电离,且溶液中H+或OH-浓度越大,由水电离出的H+浓度越小;盐的水解能促进水的电离,即由水电离出c(H+)的从大到小的顺序为④②③①。(2)二者完全反应生成NaCl和NH3·H2O,NH3·H2O电离使溶液呈碱性,即c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+)。(3)温度升高时KW增大,T℃时KW>1×10-14,即T℃>25℃;NaOH溶液中n(OH-)=0.01a mol,H2SO4中n(H+)=0.1bmol ,根据混合后溶液pH=10,得10-3= 解得a:b=101∶9。(4)两溶液完全中和,则溶液中n(H+)=c(OH-),即10-xa=10y-14b,整理得
解得a:b=101∶9。(4)两溶液完全中和,则溶液中n(H+)=c(OH-),即10-xa=10y-14b,整理得 =10x+y-14,①若x+y=14时,a/b=1;②若x+y=13,则a/b=0.1;③若x+y>14,则a/b=10x+y-14;④两溶液完全中和,则有
=10x+y-14,①若x+y=14时,a/b=1;②若x+y=13,则a/b=0.1;③若x+y>14,则a/b=10x+y-14;④两溶液完全中和,则有 =10x+y-14即lg(a/b)=x+y-14,解得x+y=14+lg(a/b)。
=10x+y-14即lg(a/b)=x+y-14,解得x+y=14+lg(a/b)。
本题难度:一般
4、选择题 已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g);△H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1);△H2=-57.3kJ/mol
下列结论正确的是(?)
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.稀硫酸与稀NaOH溶液反应的中和热△H=-57.3kJ/mol
D.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
参考答案:AC
本题解析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以碳完全燃烧放热多,但放热越多,△H越小,选项A正确,B不正确;浓硫酸溶于水会放出大量的热,所以选项D不正确,C正确,答案选AC。
本题难度:一般
5、选择题 下列有关电解质溶液中微粒的物质的量浓度关系正确的是(?)
A.在0.1 mol·L-1NaHCO3溶液中:c(Na+) >c(OH-)>c(HCO3-) >c(H+)
B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(Na+) -c(HCO3-)
C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(Na+)+c(H+) =c(OH-) +c(HCO3-) +c(CO32-)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]: c(CH3COO-) =0.1 mol·L-1
参考答案:D
本题解析:HCO3-的水解程度或电离程度均是很小的,A不正确,应该是c(Na+) >c(HCO3-) >c(OH-) >c(H+);根据电荷守恒可知,c(Na+)+c(H+) =c(OH-) +c(HCO3-) +2c(CO32-),因此选项BC 都是错误的;同样根据电荷守恒可知,D正确,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。试题在注重对基础知识巩固与训练的同时,侧重对学生能力的培养。该题的关键是利用好几个守恒关系,即电荷守恒、物料守恒和质子守恒,并能结合同样灵活运用。
本题难度:简单