微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在FeCl2、CuCl2和FeCl3的混合溶液中加入铁粉,充分反应后,滤出的不溶物中除铜粉外,还有少量铁粉,则滤液中
A.肯定有Fe2+,可能有Fe3+
B.肯定有Fe3+,一定没有Cu2+
C.肯定有Cu2+,一定没有Fe3+
D.肯定有Fe2+,一定没有Fe3+和Cu2+
参考答案:D
本题解析:略
本题难度:简单
2、填空题 氟化铜是一种锂/氟化铜电池正极活性材料,可通过下列方法制备:在铂皿中将氧化铜用过量的40%氢氟酸溶解,先制成CuF2·5HF·5H2O,再将生成物放入镍管内的铂舟中,在干燥的氟化氢气流中以400%进行加热脱水,最后通入氮气。
(1)制备过程中用铂皿而不用玻璃器皿的原因是______________________________________(用化学方程式表示)。
(2) 锂/氟化铜电池放电时总反应为置换反应,其化学方程式为____________________________________________________。
(3)准备称取上述制备的样品(仅含CuF2和CuO) 2.120 g,在通风橱中加入稀硫酸至完全溶解,然后加入足量的氢氧化钠溶液,得沉淀,将沉淀充分灼烧,得1.680 g黑色固体,计算样品中CuF2和CuO的物质的量之比。
参考答案:(1)SiO2+4HF=SiF4↑+2H2O
(2)CuF2+2Li=Cu+2LiF
(3)20:1
本题解析:(1)氢氟酸会腐蚀玻璃,生成SiF4。(2)题给信息中已经标明了反应物是锂和氟化铜,且注明了反应类型。(3)由题意知:CuF2、CuO→CuSO4→Cu(OH)2→CuO,故可用差量法求出CuF2。
CuF2 ~ CuO Δm
102 g ?80 g?22 g
m(CuF2) 2.120 g-1.680 g=0.440 g
m(CuF2)=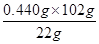 =2.040 g
=2.040 g
n(CuF2)=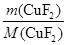 =
=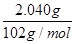 =0.020 mol
=0.020 mol
m(CuO)=2.120 g-2.040 g=0.080 g
n(CuO)=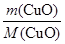 =
=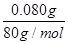 =0.001 mol,
=0.001 mol,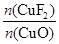 =
= =20∶1
=20∶1
本题难度:一般
3、填空题 在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为______________________________;
(2)过程Ⅰ加入铁屑的主要作用是________,分离得到固体的主要成分是______________,从固体中分离出铜需采用的方法是________________;
(3)过程Ⅱ中发生反应的化学方程式为______________;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为________。(列式计算)
参考答案:(1)2Fe3++Cu=2Fe2++Cu2+
(2)回收铜 Cu和Fe 加盐酸反应后过滤
(3)FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2?4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)c(Fe3+)=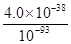 =4.0×10-11 mol·L-1
=4.0×10-11 mol·L-1
本题解析:(2)加入铁屑可置换出铜,铁过量,固体为铁与铜的混合物,要分离出铜应加入盐酸后过滤;(3)过程Ⅱ中亚铁离子生成Fe(OH)2,鼓入空气使Fe(OH)2转化成Fe(OH)3;(4)由Ksp=c(Fe3+)·c3(OH-),c(OH-)=KW/c(H+),可求得c(Fe3+)。
本题难度:一般
4、填空题 某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下:

回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式?;
(2)“酸溶”中反应的离子方程式为?;
(3)“过滤”后滤液中金属阳离子有?;
(4)“氧化”中使用的氧化剂最好是?;
(5)该工艺流程中产生的SO2会污染空气并形成酸雨,下列物质:①BaCl2②品红③石灰乳 ④O2,用于吸收SO2最好的是?。
参考答案:(1)3FeS2+8O2 Fe3O4+6SO2;(没配平扣1分,无高温不扣分。)?
Fe3O4+6SO2;(没配平扣1分,无高温不扣分。)?
(2)Fe3O4+8H+=2Fe3++Fe2++4H2O;(没配平扣1分,多写其它的离子方程式既不给分也不扣分。)
(3)Fe3+、Fe2+(各1分); (4)Cl2(H2O2等只要合理也可);(5)③
本题解析:(1)由题意可知硫铁矿中铁被氧化成了Fe3O4,可知反应式为3FeS2+8O2 Fe3O4+6SO2 ;
Fe3O4+6SO2 ;
(2)Fe3O4可溶解于盐酸中,反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O ;
(3)由Fe3O4的组成可知铁的化合价为+2和+3;
(4)氧化剂的加入是为了把其中的+2铁氧化成+3,只要不引入杂质即可,如Cl2、O3、H2O2 均可;
(5)吸收尾气SO2 工业上一般用碱性物质,如石灰乳。
本题难度:一般
5、计算题 用含杂质(杂质不与酸作用,也不溶于水)的铁10克与50克稀硫酸完全反应后,滤去杂质,所得液体质量为55.4克,求此铁的纯度。
参考答案:设此铁的纯度为x。
Fe+H2SO4=FeSO4+H2↑溶液质量增加(差量)
56 2 ?56-2=54
10x克 ?55.4克-50克= 5.4克
56∶54=10x克∶5.4克
此铁的纯度为56%。
本题解析:
Fe+H2SO4=FeSO4+H2↑
56? 2
由化学方程式可知,影响溶液质量变化的因素是参加反应的铁和生成的氢气。每有56份质量的铁参加反应"进入"溶液中的同时,则可生成2份质量的氢气从溶液中逸出,故溶液质量增加 56-2=54(份)。由题目给的差量 55.4克-50克=5.4克,据此便可列比例求解。
本题难度:简单