微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在标准状况下,将O2与NO按3∶4的体积比充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面逐渐上升,(假设烧瓶内溶液不向外扩散)最后烧瓶内溶液的物质的量浓度为(?)
A.0.045 mol·L-1
B.0.036 mol·L-1
C.0.026 mol·L-1
D.0.030 mol·L-1
参考答案:C
本题解析:4NO+3O2+2H2O====4HNO3,假设烧瓶的体积为7 mol×22.4 L·mol-1,最后烧瓶被充满,生成4 mol硝酸,硝酸溶液的物质的量浓度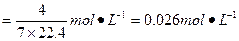 。
。
本题难度:简单
2、选择题 关于硝酸的说法正确的是(?)
A.硝酸与金属反应时,不会表现出酸性
B.浓硝酸与浓盐酸按1∶3的体积比所得的混合物叫王水
C.硝酸电离出的H+离子,能被锌、铁等金属还原成H2
D.常温下,向浓硝酸中投入铁片,会产生大量的红棕色气体
参考答案:B
本题解析:A不正确,硝酸和金属反应既表现出氧化性,也表现出酸性;硝酸是氧化性酸,和金属反应得不到氢气,C不正确;常温下,铁在浓硝酸中钝化,得不到红棕色气体,D不正确,答案选B。
点评:该题是中等难度的试题,试题基础性强,难易适中。主要是考查学生对硝酸性质的了解掌握程度,有利于培养学生的应试能力,提高学生的学习效率,增强学生的学习自信心。该题的关键是熟练记住学生的性质,并能灵活运用。
本题难度:一般
3、选择题 合成氨生产工艺的成功开发为植物的生长提供了足够的氮肥。氨气的化学式是
A.NH3
B.N02
C.N0
D.NH4C1
参考答案:A
本题解析:氨气为氮的氢化物。
本题难度:简单
4、填空题 NH3经一系列反应可以得到HNO3,如下图所示。

(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是_____________________。
(2)II中,2NO(g)+O2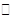 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如右图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如右图)。
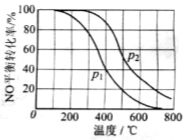
①比较P1、P2的大小关系:________________。
②随温度升高,该反应平衡常数变化的趋势是________________。
(3)III中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)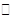 ?N2O4(g)△H1?
?N2O4(g)△H1?
2NO2(g) ?N2O4(l)△H2?
?N2O4(l)△H2?
下列能量变化示意图中,正确的是(选填字母)_______________。

②N2O4与O2、H2O化合的化学方程式是_________________。
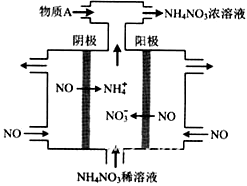
(4)IV中,电解NO制备 NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____________,说明理由:________________。
参考答案:(1)4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(2)①P1<P2;
②减小;
(3)①A;
②2N2O4+O2+2H2O=4HNO3;
(4)氨气;根据反应8NO+7H2O 3NH4NO3+2HNO3,电解产生的HNO3多
3NH4NO3+2HNO3,电解产生的HNO3多
本题解析:(1)氨气和氧气在催化剂作用下发氧化还原反应,生成NO和水,化学方程为4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(2)①该反应的正反应为气体物质的量减小的反应,其他条件不变时,增大压强,平衡向气体物质的量减小的方向移动,即向正反应方向移动,即压强越高,NO的平衡转化率越大,根据图示知,相同温度下,压强P1时NO的转化率<P2时NO的转化率,故P1<P2;
②其他条件不变时,升高温度,平衡向着吸热反应方向移动,又根据图示知,相同压强下,随着温度的升高,NO的转化率降低,即升高温度,平衡向逆反应方向移动,故逆反应方向为吸热反应,则正反应方向是放热反应,则随着温度的升高,该反应的平衡常数减小;
(3)①?
2NO2(g) ?N2O4(g)△H1?①
?N2O4(g)△H1?①
2NO2(g) ?N2O4(l)△H2?②
?N2O4(l)△H2?②
根据盖斯定律:①-②得
N2O4(g)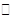 ?N2O4(l) △H3=△H1-△H2,一般来说,物质由气态变为液态,放出热量,即△H3=△H1-△H2<0,即△H1>△H2,由降低温度,将NO2转化为N2O4,可知该反应为放热反应,即0>△H1>△H2,即反应物2NO2(g)的总能量大于生成物N2O4(g)和N2O4(l)的总能量,且前者放出的热量小,故答案为A;
?N2O4(l) △H3=△H1-△H2,一般来说,物质由气态变为液态,放出热量,即△H3=△H1-△H2<0,即△H1>△H2,由降低温度,将NO2转化为N2O4,可知该反应为放热反应,即0>△H1>△H2,即反应物2NO2(g)的总能量大于生成物N2O4(g)和N2O4(l)的总能量,且前者放出的热量小,故答案为A;
②N2O4与氧气、水反应生成硝酸,化学方程式为:2N2O4+O2+2H2O=4HNO3;
(4)电解NO制备硝酸铵,阳极反应为:NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出若要使电子得失守恒,阳极产生的NO3-的量大于阴极产生的NH4+的量,总反应为8NO+7H2O 3NH4NO3+2HNO3,故应补充适量的氨气。
3NH4NO3+2HNO3,故应补充适量的氨气。
本题难度:一般
5、填空题 根据你学习的有关氨的知识,完成下面的问题。
(1)合成氨对化学工业具有重要意义。写出氨的两种重要用途_________;__________。
(2)实验室制备氨气,下列方法中最适宜选用的是______________。
①固态氯化氨加热分解
②固体氢氧化钠中滴加浓氨水
③氯化氨溶液与氢氧化钠溶液共热
④固态氯化氨与氢氧化钙混和加热
参考答案:(1)制化肥?制硝酸(液氨作制冷剂)?(2)②④
本题解析:(1)氨气是中学中唯一的碱性气体,重要的用途是制造化肥、合成硝酸以及作为制冷剂等;
(2)氯化氢分解生成氨气和氯化氢,气体冷却后又生成氯化铵,①不正确;氢氧化钠溶于水放出大量的热量,且增大溶液中OH-浓度,进一步促进氨水分解生成氨气,②正确;氯化氨溶液与氢氧化钠溶液共热,生成的氨水浓度太小,得不到氨气,③不正确;④是实验室制取氨气的,正确,答案选②④。
点评:该题难度不大,属于基础性试题。氨气的用途需要熟练记住。关于氨气的制备除了掌握实验室制取的原理以外,还可以利用氨水的不稳定性,通过分解生成。
本题难度:一般