微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)某课外小组模拟工业流程,设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)。
(1)分别写出工业上用氨气制取NO及实验室用浓硝酸制取NO 的化学方程式:______________;___________________。
的化学方程式:______________;___________________。
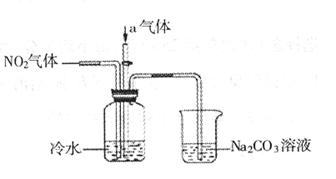
(2)连接好该装置后,首先进行的操作是:_____________________。
(3)通入的气体a是______________(填化学式),通入a的目的是:___________。
(4)盛有Na CO
CO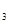 溶液的烧杯为尾气处理装置,该装置中反应的化学方程式是:
溶液的烧杯为尾气处理装置,该装置中反应的化学方程式是:
_______NO +_______Na
+_______Na CO
CO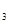 +_______H
+_______H O=NaNO
O=NaNO +_______+_______NaHCO
+_______+_______NaHCO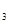 (完成此方程式)
(完成此方程式)
(5)用N O
O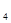 代替NO
代替NO 与水和a气体反应可生成硝酸,此反应的化学方程式是:
与水和a气体反应可生成硝酸,此反应的化学方程式是:
____________________________________。
参考答案:(12分)?(1)4NH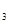 +5O
+5O
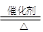 4NO+6H
4NO+6H O?(2分)
O?(2分)
Cu+4HNO3(浓)=Cu(NO3)2+2NO2 +2H2O(2分)
+2H2O(2分)
(2)检验装置的气密性(1分)
(3)O ?(1分)?可提高NO
?(1分)?可提高NO 的转化率(或2NO+O
的转化率(或2NO+O =2NO
=2NO )(2分)
)(2分)
(4)2NO2+2Na2CO3+1H2O=NaNO2+NaNO3+2NaHCO3(NaNO31分,系数1分)
(5)2N2O4+O2+2H2O=4HNO3(2分)
本题解析:(1)氨气发生催化氧化生成NO,反应的化学方程式是4NH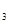 +5O
+5O
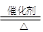 4NO+6H
4NO+6H O。实验室制取NO2常用浓硝酸和金属铜,反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2
O。实验室制取NO2常用浓硝酸和金属铜,反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2 +2H2O。
+2H2O。
(2)连接好该装置后,首先进行的操作应该是检验装置的气密性。
(3)由于NO2溶于水生成硝酸的同时,还生成NO,所以需要通入氧气氧化NO,再生成NO2,从而提高NO2的转化率。
(4)根据电子的得失守恒可配平该反应的化学方程式,即2NO2+2Na2CO3+H2O=NaNO2+NaNO3+2NaHCO3。
(5)N2O4和氧气溶于水生成硝酸,反应的化学方程式是2N2O4+O2+2H2O=4HNO3。
点评:该题是基础性试题的考查,考查的知识点比较多,但考查的都很基础,只要学生有扎实的基础以及灵活应变能力,即不能得出正确的答案。
本题难度:一般
2、选择题 某硝酸盐R(NO3)2受热分解为RO、NO2和O2,将生成的气体充满一干燥烧瓶(标准状况)再将烧瓶倒置于水中,当液面不再上升时,烧瓶中溶质的物质的量浓度为
A.0.8 mol/L
B.1/28 mol/L
C.1/14 mol/L
D.1/22.4mol/L
参考答案:B
本题解析:
因R(NO3)2受热分解产生的NO2和O2体积比为4:1,恰好完全反应:4NO2+O2+H2O=4HNO3,反应完后试管内没有气体,试管中完全充满水,溶质为HNO3,设烧瓶体积为VL,则HNO3溶液的体积也是VL,
4NO2?+O2?+2H2O═? 4HNO3
4?1?2?4?
4V/(5×22.4)mol?4V/(5×22.4)mol
则C(HNO3)=n/v=
=
=1/28mol·L-1,
故选:B
本题难度:一般
3、选择题 下列气体不溶于水,且密度比空气小的是
A.NO
B.HCl
C.NH3
D.N2
参考答案:D
本题解析:四种气体中不溶于水的有NO和N2,但密度比空气小的只有N2.
本题难度:简单
4、选择题 氨水中溶质粒子数目最多的是(?)
A.NH3
B.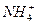
C.NH3·H2O
D.OH-
参考答案:C
本题解析:NH3与水易结合成NH3·H2O而NH3·H2O只发生微弱电离。所以氨水中NH3·H2O浓度最大,即数目最多,而NH3和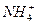 、OH-都较少。
、OH-都较少。
本题难度:简单
5、实验题 (8分,每空2分)氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:
(1)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
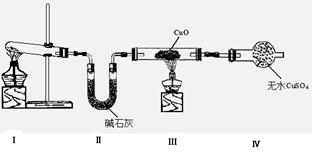
①装置Ⅰ中制取氨气 的化学方程式为?。
的化学方程式为?。
②装置Ⅲ、Ⅳ中的实验现象分别是:黑色CuO变为红色;白色无 水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。
水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。
请写出氨气与CuO反 应的化学方程式?
应的化学方程式? ?;?
?;?
③装置Ⅱ中碱石灰的作用是??。?
(2)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu2O+2H+=" Cu" + Cu2+ +2H2O)。
请你设计一个简单的实验检验该红色物质中是否含有Cu2O。? ?
?
??。
参考答案:

本题解析:略
本题难度:一般