| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《原电池原理》考点强化练习(2017年押题版)(十)
 参考答案:A、在Zn、Cu、CuSO4构成的原电池中,锌做负极,铜做正极,和原电池的正极相连的是电解池的阳极,和原电池的负极相连的是电解池的阴极,所以Y为阴极,发生还原反应,故A正确; 本题解析: 本题难度:一般 2、填空题 已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题: |
 丙。则:
丙。则: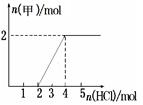
参考答案:Ⅰ.①FeCl3+3H2O Fe(OH)3↓+3HCl↑(2分)
Fe(OH)3↓+3HCl↑(2分)
②第三周期,第ⅢA族(2分); B D (2分,少选1分,错选不得分)
③Al-3e-+4OH-=AlO2-+2H2O (3分)
Ⅱ.①CO2+C 2CO (2分); ②0.5NA或3.01×1023(2分)
2CO (2分); ②0.5NA或3.01×1023(2分)
③c (Na+) > c(CO32-) > c(OH-) >c(HCO3-)>c(H+)(3分)
本题解析:Ⅰ.①甲为三价金属氯化物,常见的只有铝和铁,又因为生成的氯化物为红棕色粉末,所以甲一定为FeCl3,则甲发生a反应的化学方程式为:FeCl3+3H2O Fe(OH)3↓+3HCl↑
Fe(OH)3↓+3HCl↑
②若甲为某短周期金属元素的氯化物,则该金属为Al,在元素周期表中位于:第三周期,第ⅢA族;30 mL 1 mol/L的甲的溶液含AlCl30.03mol,逐渐加入浓度为4 mol/L的NaOH溶液,产生0.78 g白色沉淀,为0.01mol的Al(OH)3,可能为AlCl3与NaOH直接反应生成0.01molAl(OH)3,Al3++3OH?=Al(OH)3↓加入的NaOH溶液的体积为:0.01mol×3÷4mol?L?1=0.0075L=7.5mL,也可能为AlCl3与NaOH全部反应转化为Al(OH)3,继续滴加NaOH溶液,溶解部分Al(OH)3,剩余的Al(OH)3为0.01mol,Al3++3OH?=Al(OH)3↓需要NaOH为3n(Al3+)=0.03mol×3=0.09mol,Al(OH)3+OH? ==AlO2-+2H2O,需要NaOH为0.03mol-0.01mol=0.02mol,共需要NaOH溶液:(0.09mol+0.02mol)÷4mol?L?1=0.0275L=27.5mL,故BD项。
③由于在碱性溶液中,只有铝能失电子发生反应,所以Al为负极,失去电子转化为AlO2-,所以负极反应式为:Al-3e-+4OH-=AlO2-+2H2O。
Ⅱ.①甲、乙、丙为短周期元素,乙为固体单质,甲丙为气体,甲、乙高温下生成丙,且三者均位于同一周期,只可能为C、N、O三元素组成的化合物,综合分析可知:甲为CO2,乙为碳,丙为CO,所以该反应的化学方程式为:CO2+C 2CO。
2CO。
②气体甲与足量的过氧化钠反应为:2CO2+2Na2O2=2Na2CO3+O2,根据化合价的变化可得:CO2 ~ e?,所以0.5 mol气体甲与足量的过氧化钠反应,转移电子的数目为0.5NA或3.01×1023。
③根据n(HCl)与生成n(甲)的关系图,两段需要的HCl相等,说明溶液A的溶质为Na2CO3,故各离子浓度由大到小的顺序为:c (Na+) > c(CO32-) > c(OH-) >c(HCO3-)>c(H+)
考点:本题考查元素化合物的推断、方程式的书写、根据化学方程式的计算、原电池原理、电子转移、离子浓度比较。
本题难度:困难
3、填空题 (4分)某同学要在一个铁手镯上通过原电池原理覆盖一层银。
①写出该电池的负极反应式: ,发生 反应,
②正极反应式为: ,发生 反应。
参考答案:①Zn-2e-=Zn2+或Mg对应或Al-3e-=Al3+ 氧化
②2Ag++2e-=2Ag 还原
本题解析:考查原电池的设计
由题目要求可知,手镯应当做正极,电解质溶液中的Ag+得电子析出:2Ag++2e-=2Ag;较铁活泼的金属做负极,失电子,发生氧化反应,例如镁、锌或铝等:Zn-2e-=Zn2+、Mg-2e-=Mg2+、Al-3e-=Al3+
本题难度:简单
4、填空题 (10分)科学家预言,燃料电池将是2l世纪获得电力的重要途径。一种甲醇燃料电池是采用铂或炭化钨作电极,在硫酸电解液中直接加入净化后的甲醇。同时向一个电极通入空气。
回答如下问题:
(1)配平电池放电时发生的化学反应方程式:
□CH3OH+□O2→□CO2+□H2O
(2)在硫酸电解液中,CH3OH(C为-2)失去电子。此电池的正极发生的反应是 ,负极发生的反应是 。
(3)电解液中的H+向?极移动;向外电路释放电子的电极是?。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其主要有两点:首先燃料电池的能量转化效率高,其次是 。
(5)甲醇燃料电池与氢氧燃料电池相比.其主要缺点是甲醇燃料电池的输出功率较低.但其主要优点是 。
参考答案:(1)2? 3? 2? 4? (2)O2+4H++4e-===2H2O?CH3OH+H2O-6e-===CO2↑+6H+
(3)正 负极 (4)减少污染? (5)甲醇比H2廉价,甲醇是液态(常温下),易于运输和保存
本题解析:(1)甲醇中碳原子是-2价的,氧化产物中碳原子是+4价的,所以1mol甲醇失去6mol电子,而1mol氧气只能得到4mol电子,所以氧化剂和还原剂的物质的量之比是3︰2,所以方程式为2CH3OH+3O2=2CO2+4H2O.
(2)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以氧气再正极通入,甲醇再负极通入。由于是酸性溶液,所以电极反应式分别为)O2+4H++4e-===2H2O、CH3OH+H2O-6e-===CO2↑+6H+。
(3)原电池中阳离子向正极移动,负极失去电子,向外电路释放电子。
(3)由于生成物是水和CO2,没有污染。
(4)由于甲醇比H2廉价,且甲醇是液态(常温下),易于运输和保存。
本题难度:一般
5、填空题 如图在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地向烧杯中央滴入硫酸铜溶液。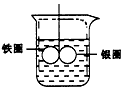
(1)片刻后可观察到的现象是(指悬吊的金属 圈)_______________。
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变 C.铁圈向下倾斜 D.银圈向下倾斜
(2)产生上述现象的原因是__________________________________。
参考答案:(1)D
(2)加入硫酸铜溶液后,构成Fe-Ag原电池,Fe溶解,减轻,Cu2+在银圈上得到电子,并沉积在其上,使其增重,所以银圈向下倾斜
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《水的电离平.. | |