微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 埋在地下的输油铸铁管道,在下列各种情况下被腐蚀速率最慢的是
[? ]
A.在潮湿疏松的土壤中
B.在含铁元素较多的酸性土壤中
C.在干燥致密不透气的土壤中
D.在含碳较多的潮湿透气的中性土壤中
参考答案:C
本题解析:
本题难度:简单
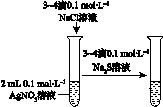
2、选择题 下图所示的实验,能达到实验目的的是
A
| B
| C
| D
|
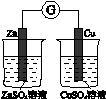
| 
| 
| 
|
验证化学能
转化为电能
| 验证铅蓄电池
放电时Pb为负极
| 验证铁
发生析氢腐蚀
| 验证AgCl
溶解度小于Ag2S
|
?
参考答案:B
本题解析:盐桥组成原电池,验证验证化学能转化为电能。但是没有形成闭合回路,A错误。原电池放电时Pb为负极,PbO2为正极。验证铁的吸氧腐蚀,C错误。验证Ag2S的溶解度小于AgCl。
本题难度:一般
3、简答题 Ⅰ污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀.下列物质不能作为沉淀剂的是______
A.氨水?B.硫化氢气体
C.硫酸钠溶液?D.纯碱溶液
Ⅱ合成氨的流程示意图如下:
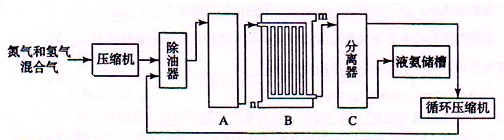
回答下列问题:
(1)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是______,______;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式______,______;
(2)设备A中含有电加热器、触煤和热交换器,设备A的名称______,其中发生的化学反应方程式为______;
(3)设备B的名称______,其中m和n是两个通水口,入水口是______(填“m”或“n”).不宜从相反方向通水的原因______;
(4)设备C的作用______;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:
CO(g)+H2O(g)?CO2?(g)+H2?(g)
已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于______.
参考答案:ⅠA.加入氨水,易形成络离子,不能生成沉淀,故A错误;
B.加入硫化氢气体,生成硫化铜、硫化汞、硫化铅等沉淀,故B正确;
C.不能使Cu2+生成沉淀,故C错误;
D.均能通过双水解调节pH转化为沉淀,故D正确.
故答案为:AC;
Ⅱ(1)分离空气提取氮气的方法有两种,以上液化、分馏空气,另一种为空气与碳反应生成二氧化碳,反应后除去二氧化碳气体;C和水反应的方程式为C+H2O?高温?.? CO+H2,甲烷与水反应的方程式为CH4+H2O催化剂.△ CO+3H2,
故答案为:液化、分馏;与碳反应后除去CO2;C+H2O?高温?.? CO+H2;CH4+H2O催化剂.△ CO+3H2;
(2)合成氨的设备为合成塔,发生N2(g)+3H2(g) 高温、高压
本题解析:
本题难度:一般
4、选择题 下列实验设计合理的是( )
A.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入H2O和Na2CO3、Ba(OH)2、HCl溶液
B.
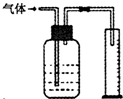
如图所示装置能用于测量气体的体积
C.用pH试纸可测某新制氯水的pH
D.航海船只的船底四周镶嵌锌块来保护船体
参考答案:A.如先加入Na2CO3再加入Ba(OH)2,过量Ba2+不能除去,应先加入Ba(OH)2,再加入Na2CO3,故A错误;
B.导管应短进长出,将水排到量筒中可测量气体的体积,故B错误;
C.氯水含有HClO,具有氧化性和漂白性,可漂白试纸,不能用pH试纸,应用pH计测量,故C错误;
D.锌比铁活泼,作原电池的负极,从而保护铁不被腐蚀,故D正确.
故选D.
本题解析:
本题难度:简单
5、选择题 某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,下列说法中正确的是
Fe(OH)2+Ni(OH)2,下列说法中正确的是
A.放电时,负极上发生反应的物质是NiO2
B.放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2
C.充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O
D.充电时,阳极附近pH值减小
参考答案:D
本题解析:由总反应式Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2可知,根据原电池在放电时,负极发生氧化反应,正极发生还原反应,再根据元素化合价变化,可判断该电池负极发生反应的物质为Fe,正极为NiO2。此电池为碱性电池,在书写电极反应和总电池反应方程式时不能出现H+,故放电时的电极反应是:负极:Fe—2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-。原电池充电时,发生电解反应,此时阴极反应为原电池负极反应的逆反应,阳极反应为原电池正极反应的逆反应。A、放电时,Fe元素化合价升高,被氧化,应为原电池负极,故A不正确;B、此电池为碱性电池,反应方程式时不能出现H+,放电时,正极反应是NiO2+2e-+2H2O=Ni(OH)2+2OH-,故B错误;C、充电时,阴极反应为原电池负极反应的逆反应,阴极反应是Fe(OH)2+2e-=Fe+2OH-,故C错误;D、充电时,阳极反应为Ni(OH)2+2OH--2e-=NiO2+2H2O,OH-浓度减小,则阳极附近pH值减小,故D正确,答案选D。
Fe(OH)2+Ni(OH)2可知,根据原电池在放电时,负极发生氧化反应,正极发生还原反应,再根据元素化合价变化,可判断该电池负极发生反应的物质为Fe,正极为NiO2。此电池为碱性电池,在书写电极反应和总电池反应方程式时不能出现H+,故放电时的电极反应是:负极:Fe—2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-。原电池充电时,发生电解反应,此时阴极反应为原电池负极反应的逆反应,阳极反应为原电池正极反应的逆反应。A、放电时,Fe元素化合价升高,被氧化,应为原电池负极,故A不正确;B、此电池为碱性电池,反应方程式时不能出现H+,放电时,正极反应是NiO2+2e-+2H2O=Ni(OH)2+2OH-,故B错误;C、充电时,阴极反应为原电池负极反应的逆反应,阴极反应是Fe(OH)2+2e-=Fe+2OH-,故C错误;D、充电时,阳极反应为Ni(OH)2+2OH--2e-=NiO2+2H2O,OH-浓度减小,则阳极附近pH值减小,故D正确,答案选D。
本题难度:一般