微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 等质量的下列物质分别与足量的盐酸反应,放出二氧化碳气体最多的是(?)
A.Ca(HCO3)2
B.NaHCO3
C.Na2CO3
D.CaCO3
参考答案:A
本题解析:题干的要求可变换为生成等量的CO2,所耗物质的质量最小的,
Ca(HCO3)2+2HCl CaCl2+2CO2↑+2H2O
CaCl2+2CO2↑+2H2O
162× ="81?" 44
="81?" 44
NaHCO3+HCl NaCl+CO2↑+H2O
NaCl+CO2↑+H2O
84? 44
Na2CO3+2HCl 2NaCl+CO2↑+H2O
2NaCl+CO2↑+H2O
106? 44
CaCO3+2HCl CaCl2+CO2↑+H2O
CaCl2+CO2↑+H2O
100? 44
本题难度:简单
2、填空题 (6分)(1)Na2O2可用在潜水艇里作为氧气的一种来源,供人们呼吸所需。Na2O2所发生反应的化学方程式为?
(2)钠和水反应的化学方程式?
(3)铝和氢氧化钠溶液反应的化学方程式?
参考答案:(1) 2Na2O2+2CO2=2Na2CO3+O2
(2)2Na+2H2O=2NaOH+H2↑
(3) 2 Al+2NaOH+2H2O=" 2" NaAlO2+3H2↑
本题解析:(1)过氧化钠能和CO2反应生成碳酸钠和氧气,所以可以作为供氧剂,反应的方程式是2Na2O2+2CO2=2Na2CO3+O2。
(2)钠极易和水反应生成氢氧化钠和氢气,反应的方程式是2Na+2H2O=2NaOH+H2↑。
(3)金属铝能和强碱溶液反应生成氢气,反应的化学方程式是2 Al+2NaOH+2H2O=" 2" NaAlO2+3H2↑。
点评:该题属于基础性试题,关键是记住常见物质的化学性质及其相应的方程式。
本题难度:一般
3、选择题 纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。下列区分这两种物质的方法正确的是?(?)
A.分别用炒锅加热两种样品质量减少的是苏打
B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,火焰颜色呈黄色的是小苏打
C.等质量的碳酸钠和碳酸氢钠分别与足量等浓度的盐酸反应,后者产生二氧化碳速度快
D.先将两样品配成溶液,后分别加入石灰水,无白色沉淀生成的是小苏打
参考答案:C
本题解析:A项注意Na2CO3的俗称为纯碱或苏打,它受热不会分解,质量不会减少;NaHCO3的俗称为小苏打,受热会分解,所以质量减少的是小苏打,A项错误。B项因为Na2CO3和NaHCO3都含有钠元素,所以灼烧时火焰颜色相同,B项错误。C项NaHCO3与HCl反应速率快一些,因为碳酸钠反应需结合两步H+才产生气体,C正确。D项加入石灰水即Ca(OH)2都有白色沉淀产生,D错误。
点评:熟悉这两种钠盐的性质,并注意其不同之处,并在此类题中认真分析和熟练应用
本题难度:简单
4、填空题 (10分)如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要的固氮反应。
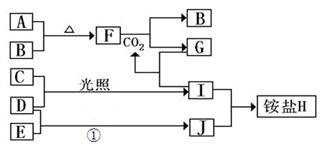
(1)单质E的结构式_____________
(2)F和H2O反应的化学方程式为_____________________________,该反应中被氧化与被还原的物质的物质的量之比是_________________
(3)铵盐H中阳离子的电子式_______________,检验H 中阳离子的方法是____________________
_____________________________________________________________________________
参考答案:(1)N≡N
(2)2Na2O2+2H2O=4NaOH+O2↑ ;? 1:1
(3)? ;取少量H样品放入试管中,加入NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明含有NH4+
;取少量H样品放入试管中,加入NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明含有NH4+
本题解析:化合物G的焰色反应为黄色,含有Na元素,F能与二氧化碳反应得到气体单质B与G,可推知F为Na2O2,B为O2,G为Na2CO3,而A与B(氧气)反应得到F(过氧化钠),则A为Na.G(Na2CO3)与I反应得到CO2,则I属于酸,I由气体非金属单质C与D在光照条件下得到,则I为HCl,C、D分别为H2、Cl2中的一种,I和J通常状况下呈气态,二者反应得到铵盐,且反应①是化工生产中的一种重要固氮反应,可推知J为NH3,D为H2,E为N2,铵盐H为NH4Cl,故C为Cl2;
(1)单质E为N2,分子中N原子之间形成3对共用电子对,其结构式为N≡N;
(2)F为过氧化钠,与H2O反应生成氢氧化钠与氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,该反应中被氧化与被还原的物质都是过氧化钠,由电子转移守恒可知,被氧化与被还原过氧化钠的物质的量之比是1:1;
(3)铵盐H为NH4Cl,NH4+离子的电子式为 ,检验NH4+离子的方法是:取少量H?样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子。
,检验NH4+离子的方法是:取少量H?样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子。
本题难度:一般
5、填空题 (1)取一支大试管,加入15mL的水与苯(r=0.87g/cm3),静置。取黄豆粒大小的金属钠(r=0.97g/cm3),轻轻放入这支装有水和苯的试管,试推断观察到的现象是。
(2)在实验室里,有一瓶浸在煤油里的钠块,要取用金属Na进行上述实验,取用的操作方法
参考答案:(1)钠块将落在苯和蒸馏水的界面上,有气泡产生,使钠块上浮,当附着在钠块表面的氢气逸出后,钠块又下沉到水和苯的界面上,又发生反应,重复发生上述现象直至钠块反应耗尽。
(2)用镊子取出钠块,用滤纸擦净表面上的煤油,在玻璃片上用小刀切去表面的氧化层,再切下一小粒备用,余下的钠全部放回试剂瓶的煤油里。
本题解析:根据钠、水、苯的密度大小可推知钠应处于水和苯的交界处。从煤油中取出钠、钾属于药品取用的基本操作。但要特别注意,其他药品取用时,剩余药品,不能放到试剂瓶中,但剩余的钠、钾必须全部放回试剂瓶中。
本题难度:一般