微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图是工业制纯碱的部分物质转化示意图,下列推测错误的是
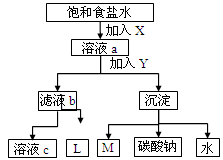
A.若是联碱法,溶液c可在转化流程中循环利用
B.若是氨碱法,则L的主要成分是NaCl
C.M可在转化流程中循环利用
D.X是NH3,Y是CO2
参考答案:AB
本题解析:A、若是联碱法,则X是氨气,Y是CO2,c是氯化铵溶液不能在转化流程中循环利用,A不正确;B、若是氨碱法,则L的主要成分是CaCl2,B不正确;C、M是CO2可以循环利用,C正确;D、由于氨气极易溶于水而CO2在水中的溶解性不大,所以X是NH3,Y是CO2,D正确,答案选AB。
本题难度:一般
2、选择题 下列有关钠的物理性质的叙述中正确的是(?)
①银白色金属?②质软,可以用小刀切割?③熔点低
④密度比水小?⑤热和电的良导体
①②④? B.①②③④? C.①③④? D.①②③④⑤
参考答案:D
本题解析:钠的物理性质:①银白色金属②质软,可以用小刀切割③熔点低 ④密度比水小⑤热和电的良导体。
本题难度:一般
3、选择题 杨老师在课堂上出示两瓶失去标签的Na2CO3和NaHCO3无色饱和溶液,希望班里同学提出简便的鉴别方法,该班同学踊跃提出看法,其中不合理的是
①用干燥的pH试纸检验,pH大的是Na2CO3
②取同量的溶液于两支试管中,各滴入酚酞试液,红色较深的是Na2CO3
③取同量的溶液于两支试管中,加热,有气泡产生的是NaHCO3
④取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO3
⑤取同量的溶液于两支试管中,滴加BaCl2溶液,生成白色沉淀的是Na2CO3
⑥取同量的溶液于两支试管中,滴加Ba(OH)2溶液,生成白色沉淀的是Na2CO3
A.①②
B.③⑥
C.④⑤
D.②⑤
参考答案:B
本题解析:①Na2CO3水解程度大,溶液碱性强,所以pH大的是Na2CO3,正确;②Na2CO3水解程度大,溶液碱性强,滴入酚酞试液,红色较深,正确;③NaHCO3溶液中加热没有气泡产生,错误;④取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO3,正确;⑤BaCl2溶液,与Na2CO3反应生成BaCO3沉淀,而NaHCO3不反应,正确;⑥取同量的溶液于两支试管中,滴加Ba(OH)2溶液,均生成白色沉淀,错误。故选择B。
本题难度:一般
4、选择题 纯碱(Na2CO3) 在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图:
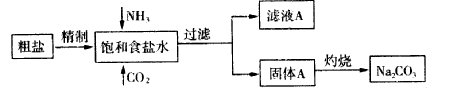
已知:向饱和食盐水中通入NH3、CO2后发生的反应为NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl。请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。
精制除杂的步骤顺序a→_______→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣;
b.加入盐酸调pH;
c.加入Ba(OH) 2溶液;
d.加入Na2CO3溶液;
e.过滤
向饱和食盐水中先通入NH3,后通入CO2,理由是_____________________。
(2)灼烧固体A制Na2CO3应在_____(填字母序号)中进行。
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是 。对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3,使pH降低,反应的离子方程式______________________。
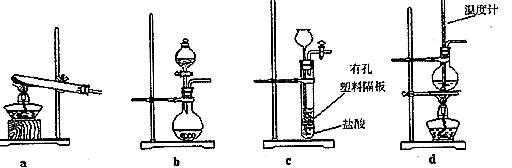
(3)下图装置中常用于实验室制备CO2的是_____(填字母编号);用b示意的装置制备NH3时,分液漏斗中盛放的试剂______(填试剂名称),烧瓶内可加入的固体试剂 (填试剂名称)。
(4)一种天然碱晶体成分是aNa2CO3·bNa2SO4·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实验方案。请把实验方案补充完整(仪器自选):
供选择的试剂:1.0 mol·L-1H2SO4溶液、1.0 mol·L-1BaCl2溶液、稀氨水、碱石灰、Ca(OH) 2溶液、蒸馏水
①称取m1 g一定量天然碱晶体样品,溶于适量蒸馏水中;
②_________________________________________________________________;
③_________________________________________________________________;
④计算天然碱晶体中含Na2CO3的质量分数。
参考答案:(1)c d e(2分);NH3易溶于水,有利于吸收溶解度不大的CO2(1分)
(2) a (1分) 取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+。(2分)? NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O (2分)
(3)b c (2分)浓氨水( 1分) 、生石灰(或NaOH固体或碱石灰)( 1分) ;
(4)②加入足量稀硫酸并微热,产生的气体通过足量的澄清石灰水,(1分)③过滤、洗涤、干燥、称量沉淀;(2分)
本题解析:(1)本题考查物质的分离提纯。为保证杂质离子除尽,所加试剂要过量,过量的离子在后续操作中必须除去;根据题给信息知,加入过量Ba(OH) 2溶液可除去SO42-和Mg2+,加入过量Na2CO3溶液可除去Ca2+和过量的Ba2+,过滤后,加盐酸能除去过量的CO32—和OH—溶液,所以应先加Ba(OH)2溶液再加Na2CO3溶液,过滤,最后加入盐酸,精制除杂的步骤顺序c d e;NH3极易溶于水,有利于吸收溶解度不大的CO2,所以向饱和食盐水中先通入NH3,后通人CO2;(2)灼烧固体应在坩埚中进行,选a;证明滤液A中含有NH4+的方法是取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+;对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3,使pH降低,反应的离子方程式 NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O;(3)实验室制取二氧化碳常选用大理石和稀盐酸反应制取,固体和液体不加热制气体,选bc;用b示意的装置制备NH3时,分液漏斗中盛放的试剂为浓氨水,烧瓶内可加入的固体试剂生石灰或氢氧化钠或碱石灰;(4)根据题给信息知,该实验的原理为将碳酸根全部转换成二氧化碳,利用二氧化碳和澄清石灰水产生沉淀,通过沉淀的质量求出二氧化碳的物质的量、Na2CO3的物质的量和质量,最终求出Na2CO3的质量分数,所以补充的实验步骤应为②加入足量稀硫酸并微热,产生的气体通过足量的澄清石灰水,③过滤、洗涤、干燥、称量沉淀。
本题难度:一般
5、计算题 1块表面已经氧化为氧化钠(Na2O)的金属钠的质量为10.8 g,把它投入100 g水中,在常温下放出氢气0.2 g,求:
(1)金属钠的纯度为多少?
(2)被氧化的金属钠的质量为多少?
(3)生成氢氧化钠的质量。
(4)所得溶液中溶质的质量分数。
参考答案:设10.8 g反应物中含金属钠的质量为x,根据:
2Na+2H2O 2NaOH+H2↑
2NaOH+H2↑
23×2? 40×2? 2
x? y? 0.2 g
x=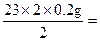 4.6 g
4.6 g
y=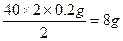
(1)金属钠的纯度: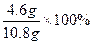 =42.59%
=42.59%
(2)反应物中含氧化钠:m(Na2O)="10.8" g-4.6 g="6.2" g
氧化钠中钠元素(即被氧化的钠)的质量为z。
62∶46="6.2" g∶z? z="4.6" g
(3)设氧化钠溶于水生成的氢氧化钠的质量为b。
Na2O+H2O 2NaOH
2NaOH
62? 2×40
6.2 g?b
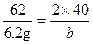 ?b="8" g
?b="8" g
m(NaOH)="8" g+8 g="16" g
(4)计算溶质的质量分数,必须求出反应后溶液的总质量,根据质量守恒关系,
m(溶液)=m(H2O)+m(Na)+m(Na2O)-m(H2)="100" g+10.8 g-0.2 g="110.6" g
溶质的质量分数为: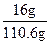 ×100%=14.47%
×100%=14.47%
答:(1)金属钠的纯度为42.59%。
(2)被氧化的金属钠的质量为4.6 g。
(3)生成的氢氧化钠的质量为16 g。
(4)溶质的质量分数为14.47%。
本题解析:10.8 g固体反应物实际上是金属钠和氧化钠的混合物,其中只有金属钠能与水反应产生氢气。而氢氧化钠是钠、氧化钠与水反应的共同产物。根据反应的化学方程式,从放出氢气的质量可求出金属钠的质量及氧化钠的质量。
解题时要注意的是:金属钠溶于水所得溶液的溶质是氢氧化钠而不是金属钠。在计算溶液中溶质的质量分数而求算溶液质量时,不能忽略反应中产生的氢气的质量,即从溶液质量中将其减去才能求出正确的溶液质量。
还须注意的是:被氧化的金属钠的质量不能理解为被氧化生成的氧化钠的质量,应先求出氧化钠的质量,再求出其中所含钠元素的质量,这才是被氧化的金属钠的质量。
本题难度:简单