微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (12分)实验室可利用乙醇、铜或铜的化合物制备乙醛,如图是某兴趣小组设计的实验装置,右侧的反应装置相同,而左侧的气体发生装置不同,试管C中装有水(加热装置未画出),试回答:
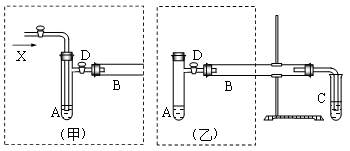
(1)?两套装置中的A、B处都需加热,A处用水浴加热,B处用__________加热,A处用水浴加热的主要优点是__________。
(2)?若按甲装置进行实验,B管处装铜粉,则通入A管的X是__________,B中反应的化学方程式是__________。
(3)?若按乙装置进行实验,则B管中应装__________,B中反应的化学方程式是__________。
(4)?实验结束后,取C试管中的溶液滴入新制备的银氨溶液并采用水浴加热可观察到有银镜生成,写出该过程的离子方程式__________ 。
(5)?实验完成后,应在C试管中加入__________可洗去银镜。
参考答案:(1)酒精灯或煤气灯 受热均匀,出气稳定
(2)O2或空气 2CH3CH2OH+O2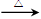 2CH3CHO+2H2O
2CH3CHO+2H2O
(3)CuO? CH3CH2OH+CuO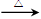 CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
(4)CH3CHO+2Ag(NH3)2+ + 2OH-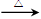 CH3COO- +NH4+ +2Ag+3NH3+H2O
CH3COO- +NH4+ +2Ag+3NH3+H2O
(5)HNO3
本题解析:水浴加热乙醇,受热均匀,乙醇催化氧化要酒精灯加热。银镜反应要先加碱
CuOCH3CH2OH+CuO CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
(4)CH3CHO+2Ag(NH3)2+ + 2OH- CH3COO- +NH4+ +2Ag+3NH3+H2O
CH3COO- +NH4+ +2Ag+3NH3+H2O
实验完成后,应在C试管中加入稀硝酸可洗去银镜。
本题难度:一般
2、实验题 氮及其化合物在生产、生活中有重要的作用。
(1)NH3是制碱工业中不可缺少的重要物质。继侯德榜“联合制碱法”后,上世纪50年代某些化工专家开始研究有机胺制碱法,其工艺流程如下:
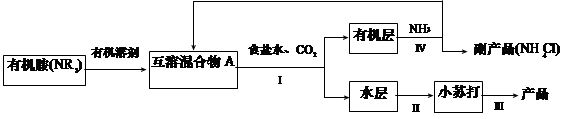
已知:NR3 + CO2 + NaCl + H2O = NaHCO3 + NR3·HCl
NR3 + HCl = NR3·HCl,且NR3·HCl 易溶于有机溶剂。
①操作Ⅰ名称为?;
②某实验小组同学查阅资料知,有机溶剂和有机胺沸点差别较大,现欲将A中各成分进行分离,请写出除了导管、酒精灯、牛角管、锥形瓶外,该分离操作所需的玻璃仪器名称 ?;
(2)N2在化工生产、农业、医疗、航天航空等领域用途广泛。现提供以下装置(连接仪器略去):
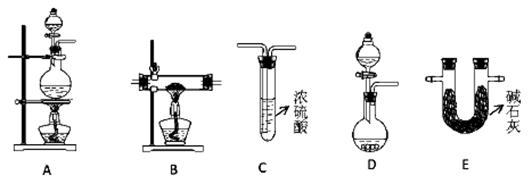
①某化学兴趣小组甲同学欲用加热NaNO2 和NH4Cl的浓溶液制得N2,应该选择的发生装置是?,检验该发生装置气密性的操作为 ?;
②在加热条件下,用NH3 还原CuO可制得N2,同时获得铜粉,此反应的化学方应方程式是?。乙同学用此法制得干燥、纯净的N2,且需要的NH3 以生石灰和浓氨水作原料。按气流从左到右,整套装置的连接顺序是?(填写字母序号);最后一个装置中试剂的作用是??;
参考答案:(1)①分液(2分)
②蒸馏烧瓶、温度计、冷凝管(2分,答对2种得1分,全答对得2分)
(2)①A (2分);关闭分液漏斗下端活塞并将导管连接长导管后置于水中(1分),用酒精灯微热圆底烧瓶,若导管口有气泡冒出,撤掉酒精灯后导管内有一段水柱,则装置气密性好(1分);反之,则装置气密性不好。
②3CuO+ 2NH3 N2+ 3Cu + 3H2O(2分);DEBC(2分);干燥N2(1分)并除去其中的NH3(1分)
N2+ 3Cu + 3H2O(2分);DEBC(2分);干燥N2(1分)并除去其中的NH3(1分)
本题解析:(1)①分离互补相溶液体的方法是分液,所以操作Ⅰ名称为分液。
②有机溶剂和有机胺沸点差别较大,可用蒸馏分离,根据蒸馏的仪器:带铁圈的铁架台,酒精灯,石棉网,蒸馏烧瓶,温度计,冷凝管,牛角管,锥形瓶,因此还缺少蒸馏烧瓶、温度计、冷凝管。
(2)①根据已知信息可知,反应物是亚硝酸钠(NaNO2)和氯化铵的浓溶液混合加热制备氮气,所以需要圆底烧瓶作反应容器,同时还需要加热,因此A装置适合;检验装置气密性的方法一般是利用压强差来进行,所以正确操作是安装好仪器后,关闭分液漏斗下端活塞并将导管连接长导管后置于水中,用酒精灯微热圆底烧瓶,若导管口有气泡冒出。撤掉酒精灯后导管内有一段水柱,则装置气密性好;反之,则装置气密性不好。
②根据原子守恒可知,NH3与CuO反应生成N2、铜和水,所以反应的化学方程式为3CuO+ 2NH3 N2+ 3Cu + 3H2O;需要的NH3 以生石灰和浓氨水作原料,因此需要用D用来制取氨气,氨气是碱性气体,不能用浓硫酸干燥,应该用E装置(碱石灰)干燥氨气。在B中反应后,剩余的氨气可用C装置来除去,同时C装置中的浓硫酸还能干燥氮气。所以按气流从左到右,整套装置的连接顺序是DEBC。
N2+ 3Cu + 3H2O;需要的NH3 以生石灰和浓氨水作原料,因此需要用D用来制取氨气,氨气是碱性气体,不能用浓硫酸干燥,应该用E装置(碱石灰)干燥氨气。在B中反应后,剩余的氨气可用C装置来除去,同时C装置中的浓硫酸还能干燥氮气。所以按气流从左到右,整套装置的连接顺序是DEBC。
本题难度:一般
3、填空题 在常温下,一氯甲烷是无色气体,密度为0.9159g/cm3,熔点-97.73℃,沸点为-24.2℃;18℃时它在水中的溶解度为280mL/L水,它与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室可用图所示装置制造一氯甲烷。
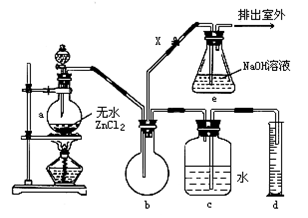
制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸,试填写下列空白.
(1)制备一氯甲烷的化学方程式为?;其反应类型是?
(2)装置b的作用是_?___
(3)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其他烃燃烧现象有明显区别),CH3Cl燃烧的化学方程式为__?__
(4)实验中实际按甲醇和浓盐酸1∶2(物质的量之比)进行反应的理由是___?_?
(5)某学生在关闭活塞X的情况下做此实验时,发现收集到一定体积的气体产物所消耗的甲醇—浓盐酸的混合液的量比正常情况下多(装置的气密性没有问题),其原因是____?
?
(6)实验结束时,d中收集到的液体中含有_?
参考答案:(1)CH3Cl+HCl →CH3Cl+HCl,取代。(2)防止倒吸、保证安全。
(3)2CH3Cl+3O2→ 2CO2+2H2O+2HCl。(4)可使甲醇充分反应,转化成一氯甲烷。
(5)甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出。
(6)甲醇、盐酸、一氯甲烷。
本题解析:分析题目所给氯乙烷的性质和所学乙醇与HX的反应分析、判断。
(1)?制备一氯甲烷的化学方程式为:CH3Cl+HCl →CH3Cl+HCl,其反应类型是取代反应。
(2)?装置b的作用是防倒吸。
(3)?CH3Cl燃烧的化学方程式为:2CH3Cl+3O2→ 2CO2+2H2O+2HCl
(4)?实验中实际按甲醇和浓盐酸1∶2(物质的量之比)进行反应的理由是: 可使甲醇充分反应,转化成一氯甲烷。
(5)?其原因是: 甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出
(6)?实验结束时,d中收集到的液体中含有甲醇、盐酸、一氯甲烷
本题难度:简单
4、实验题 某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验 ,制取氯气的装置如图I和Ⅱ。
,制取氯气的装置如图I和Ⅱ。
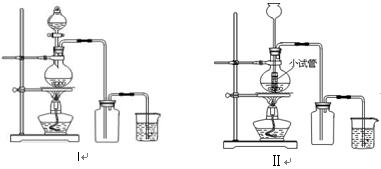
(1)制取氯气的反应的离子方程式?;
(2)装置Ⅱ中小试管的作用为?;
(3)装置I与装置Ⅱ比较,装置I的主要优点为:?。
(4)将生成的氯气通入水中,可制得氯水,氯水见光易分解生成?气体。
(5)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能,请利用中学实验室常见试剂,设计实验,得出正确结论。
提出问题
| 收集资料
| 提出假设
| 验证假设
| 得出结论
|
氯水中何种物质能使湿润的红色布条褪色?
| ①Cl2有强氧化性
②Cl2与冷水反应生成盐酸和HClO
③HClO有强氧化性
| ①?。
②盐酸使布条褪色。
③?。
④H2O使布条褪色
| 验证假设①:把红色干布条放入充Cl2的集气瓶,布条不褪色;
验证假设②:?。
验证假设④:把红色布条放在水里,布条不褪色。
| 使红色布条褪色的物质是?。
参考答案:(共16分)(1)MnO2+ 4H++ 2Cl— Mn2++ 2H2O + Cl2 ↑?(2分) Mn2++ 2H2O + Cl2 ↑?(2分)
(2)液封或防止气体溢出(2分)
(3)便于控制滴加浓盐酸,减少浓盐酸的挥发?或操作简便(2分)
(4)氧气?(2分)
(5)氯气使布条褪色?(2分)? HClO使布条褪色?(2分)
把红色布条放在盐酸溶液里不褪色(2分)?HClO?(2分)
本题解析:略
本题难度:简单
5、实验题 (14分)某学校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究。
甲同学:为制备消毒液,探究并制作了一种家用环保型消毒液(NaClO溶液)发生器,设计了如图所示的装置,用石墨作电极电解饱和氯化钠溶液。
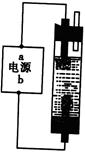
请完成下列问题:若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源的a电极名称为?极(填“正”、“负”、“阴”或“阳”);装置溶液中反应生成NaClO的离子方程式为:?。
乙同学:从某超市中查询到某品牌消毒液包装说明的部分内容,摘录如下:
主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。
请完成以下实验探究过程:
I.阅读材料,根据学过的知识判断问题?
(1)室温条件下,该消毒液(NaClO)的不显中性的原因是(用离子方程式表示)
_____________________。
(2)该消毒液还具有的化学性质是_________(填序号)。
A.强氧化性? B.强还原性? C.不稳定性? D.漂白性? E.弱酸性
(3)从该消毒液的保存要求分析,导致其失效的主要原因是(用化学方程式表示)
_?。
II.确定要研究的问题
该消毒液对碳钢制品的腐蚀原理。
III.设计方案,实施探究
(1)用烧杯取少量样品,将一颗光亮的普通碳钢钉放入烧杯,浸泡一段时间。
预期的实验现象是_________________________________。
(2)为了进一步探究铁钉在该漂白剂(NaClO)溶液中的腐蚀原理,丁同学设计了如下图实验装置,写出碳(C)极上发生的电极反应式:?。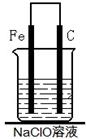
参考答案:甲:负(1分)Cl2+2OH-===Cl-+ClO-+H2O(2分)
乙:I.(1)ClO-+H2O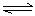 HClO+OH- (2分) HClO+OH- (2分)
(2)A、D(2分)2NaClO+CO2+H2O=Na2CO3+2HClO(2分)? 2HClO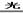 2HCl+O2↑(2分) 2HCl+O2↑(2分)
III.(1)钢钉表面有红褐色物质生成(2分)
(2)ClO-+2e-+H2O=Cl-+2OH-(2分)
本题解析:电解NaCl溶液生成氢氧化钠、氢气和氯气,氯气与氢氧化钠反应生成次氯酸钠,次氯酸钠因为水解显碱性。次氯酸钠具有强氧化性和漂白性。如果接触到空气中CO2,就会生成HClO,HClO分解就会使消毒液失效。将碳钢铁钉浸在次氯酸钠中,会发生电化学腐蚀。其中铁为负极,碳为正极。铁失电子,因为次氯酸根离子的强氧化性,次氯酸根离子得电子生成Cl—。
本题难度:简单
|