微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业。在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计下图所示装置,制取该产品。D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
Ⅰ.可选用的药品有:
a.石灰石;b.饱和氯化钙溶液;c.6 mol/L盐酸;d.氯化铵;e.氢氧化钙
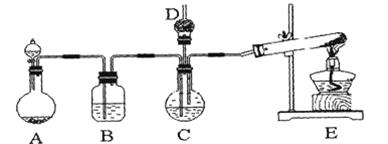
(1)A中制备气体时,所需药品是(选填字母序号)?;
(2)B中盛有饱和碳酸氢钠溶液,其作用是?;
(3)写出制取氨气的化学方程式?;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式?;
(5)检验D出口处是否有氨气逸出的方法是?;
(6)写出制纳米级碳酸钙的化学方程式?。
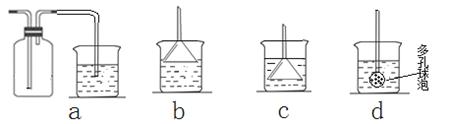
(7)若实验过程中有氨气逸出,应选用下列?装置回收(填代号)。
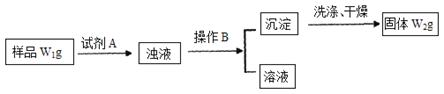
Ⅱ.经分析在上述氯化铵样品中含有杂质碳酸氢钠。为了测定氯化铵的质量分数,该学生实验小组又设计了如下实验流程:
试回答:
(1)所加试剂A的化学式为?
(2)B操作方法是?
(3)样品中氯化铵的质量分数为?。
参考答案:Ⅰ.(1)ac(1分)(2)除去CO2中的HCl(1分)?
(3)2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O?(4)NH3(1分)
CaCl2 + 2NH3↑+ 2H2O?(4)NH3(1分)
(5)将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出;若试纸不变蓝,则证明没有氨气逸出。(或用蘸有浓盐酸的玻璃棒靠近D出口处,若有白烟,则证明有氨气逸出;若没有白烟,则证明没有氨气逸出。)(2分)
(6)CaCl2 + H2O + CO2 + 2NH3 = CaCO3 + 2NH4Cl(2分)
(7)b(1分)
Ⅱ.(1)Ca(OH)2或Ba(OH)2或AgNO3和HNO3(1分)?
(2)过滤(1分)
(3)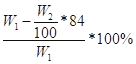 或
或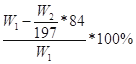 或53.5W2/143.5W1×100%
或53.5W2/143.5W1×100%
本题解析:Ⅰ.(1)分析题意知,装置A为碳酸钙与盐酸反应制二氧化碳,所需药品是石灰石和6mol/L盐酸,答案为:ac;(2)饱和NaHCO3溶液可除去二氧化碳中的氯化氢;(3)实验室制取氨气采用氯化铵和氢氧化钙加热,生成氯化钙、氨气和水,方程式为:2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O;(4)氨气极易溶于水,先通入氨气利于二氧化碳的吸收,所以应先通入NH3;(5)氨气是碱性气体,能使红色石蕊试纸变蓝;氨气能和浓盐酸反应生成白烟,答案为:将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出;若试纸不变蓝,则证明没有氨气逸出。(或用蘸有浓盐酸的玻璃棒靠近D出口处,若有白烟,则证明有氨气逸出;若没有白烟,则证明没有氨气逸出。);(6)制纳米级碳酸钙的化学方程式为:CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl;(7)氨气极易溶于水要防止倒吸,答案为:b;
CaCl2 + 2NH3↑+ 2H2O;(4)氨气极易溶于水,先通入氨气利于二氧化碳的吸收,所以应先通入NH3;(5)氨气是碱性气体,能使红色石蕊试纸变蓝;氨气能和浓盐酸反应生成白烟,答案为:将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出;若试纸不变蓝,则证明没有氨气逸出。(或用蘸有浓盐酸的玻璃棒靠近D出口处,若有白烟,则证明有氨气逸出;若没有白烟,则证明没有氨气逸出。);(6)制纳米级碳酸钙的化学方程式为:CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl;(7)氨气极易溶于水要防止倒吸,答案为:b;
Ⅱ.(1)根据题目信息可知:碳酸氢钠能与氢氧化钡或氢氧化钙反应生成碳酸钡或碳酸钙沉淀,根据沉淀的质量求出碳酸氢钠的质量,最后求出氯化铵的质量以及质量分数;氯化铵能与硝酸酸化的硝酸银反应生成氯化银沉淀,根据沉淀的质量求出氯化铵的质量,最后求出氯化铵的质量分数;所以A为Ca(OH)2或Ba(OH)2或AgNO3和HNO3;(2)操作B为不溶物和溶液分离操作,用过滤的方法;(3)若试剂为Ca(OH)2溶液,根据碳守恒得关系式:NaHCO3——CaCO3,计算得NaHCO3的质量为84W2/100g,则氯化铵的质量为(W1—84W2/100)g,氯化铵的质量分数为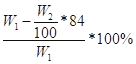 ,若试剂为Ba(OH)2溶液,同理可计算氯化铵的质量分数为
,若试剂为Ba(OH)2溶液,同理可计算氯化铵的质量分数为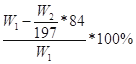 ,若试剂为AgNO3和HNO3,由关系式NH4Cl——AgCl计算得氯化铵的质量分数为53.5W2/143.5W1×100%。
,若试剂为AgNO3和HNO3,由关系式NH4Cl——AgCl计算得氯化铵的质量分数为53.5W2/143.5W1×100%。
本题难度:一般
2、实验题 (每空2分,共14分)
(一)用碳酸钠粉末配制0.2000 mol·L-1Na2CO3溶液0.5L
(1)需选用的玻璃仪器或用品?(填字母编号)
B、0.5L平底烧瓶? C、0.5L容量瓶? D、0.5L圆底烧瓶? E、烧杯? F、试管? G、胶头滴管? H、量筒? I、托盘天平? J、药匙? M、滤纸? N、玻璃棒
(2)应称取?g 碳酸钠粉末来溶于水
(二)用0.2000 mol·L-1Na2CO3溶液标定未知浓度的盐酸
(1)把0.2000 mol·L-1Na2CO3溶液装入?(酸式,碱式)滴定管中。从此滴定管中放出20. 00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据?判断滴定终点达到。
00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据?判断滴定终点达到。
(2)终点达到时,用去盐酸16.00mL(三次的平均值),则盐酸c(HCl)=?
(三)中和热的测定
用(二)实验中标定好浓度的盐酸50.0mL与0.55mol·L-1NaOH 50.0mL反应做中和热的测定实验。每次用量均一样,三次实验测得温 度升高的平均值为3.41℃,则实验测得中和热△H=?(混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论?(偏高,相等,偏低)
度升高的平均值为3.41℃,则实验测得中和热△H=?(混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论?(偏高,相等,偏低)
参考答案:(每空2分 ,?共14分)
(一)(1)CHENG?(2)10.6
(二)(1)碱式?黄色变成橙色30s不褪去
(2)0.5mol/L
(三)- 57.0 KJ/mol?偏高
本题解析:略
本题难度:简单
3、实验题 A~D是中学化学实验中常见的几种温度计装置示意图(图2-1-5)。
(1)请从①~⑧中选出必须使用温度计的实验,把编号填入最适宜的装置图A~C下的空格中(多选要倒扣分)。
①酒精和浓硫酸混合加热制乙烯
②电石跟水反应制乙炔
③分离苯和硝基苯的混合物
④苯跟溴的取代反应
⑤石油分馏实验
⑥浓盐酸和二氧化锰混合加热制氯气
⑦测定硝酸钾在水中的溶解度
⑧食盐和浓硫酸混合加热制氯化氢

(2)选用装置D做苯的硝化实验,D中长玻璃管的作用是:
参考答案:(1)A①;B③,⑤;C⑦。
(2)起冷凝回流作用(或答减少苯的挥发;或答起冷凝器的作用)。
本题解析:
【错解分析】常见错解分析:第(1)问:①在A下的空格中填入了②、③、④、⑥、⑦多个序号。②在B下的空格中只填入了序号⑤,漏填了序号③。③在C下的空格中填入了①、③、④、⑤、⑦、⑧多个序号。第(2)问:①导气;减压;排气作用;用手握住玻璃管上方,使试管底部不与烧杯底接触。②冷却;降温;冷凝剂。③冷凝回流硝酸。④冷凝回流溴苯。⑤冷凝,防回流。出现①误区,是由于不知道该反应装置,没做过(或没看见老师做过)苯的硝化实验,不懂得该实验的原理,导致失误。出现②误区,是由于不能正确表达冷凝器的作用所致。出现③误区,是由于没有抓住问题的实质,不了解长玻璃管的作用是回流苯,以减少苯的挥发。出现④误区,属于答非所问。出现⑤误区,属于自相矛盾。
【正解】第(1)问:以“必须使用温度计”为“筛子”,按A~C中学实验中常见的几种温度计装置示意图,对①~⑧实验进行分析,先确定必须使用温度计的实验是①、③、⑤、⑦,然后再逐一确定应填入A~C下哪个空格中。“①酒精和浓硫酸混合加热制乙烯”,属于液—液反应,反应需在170℃进行,温度计水银球应插在液面下。故“①”应填在A下的空格中。出现①误区是由于不知道哪些反应必须使用温度计,也不知道温度计水银球的位置,造成失误。“③分离苯和硝基苯的混合物”,液—液有机物可利用沸点不同,进行分馏以分离之,温度计水银球应位于蒸馏烧瓶侧管口处。故“③”应填在B下的空格中。“⑤石油分馏实验”,与“③”相同,也应填在B下的空格中。出现②误区,是由于不掌握液态有机物利用沸点不同分离的原理所致。“⑦测定硝酸钾在水中的溶解度”,温度计是用来测水温的,温度计插入试管中,水银球浸在液面下,且试管(连水带温度计)放在烧杯里进行水浴。故“⑦”应填在C下的空格中。出现③误区,是由于不清楚C装置的原理所致。
第(2)问:可直接从头脑中调出制取硝基苯的演示实验装置,回答长玻璃管的作用。也可以将酚醛树脂学生实验装置中,长玻璃管的作用迁移至此。回答是起冷凝回流作用(或答减少苯的挥发;或答起冷凝器的作用)。
本题难度:一般
4、实验题 碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要含有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:

Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物 质
| Cu(OH)2
| Fe (OH)2
| Fe (OH)3
|
开始沉淀pH
| 4.2
| 5.8
| 1.2
|
完全沉淀pH
| 6.7
| 8.3
| 3.2
|
?
(1)滤渣的主要成分是?(写化学式)。
(2)调节反应A后溶液的pH范围应为?。选择的试剂最合适的是?(填序号)。
a.氨水? b.稀硫酸? c.氢氧化钠? d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是?。
(4)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。用相应的离子方程式表示:
① 沉淀只有CuCO3:?;
② 沉淀只有Cu(OH)2且放出气泡:?。
(5)碱式碳酸铜的组成可表示为:aCuCO3?bCu(OH)2?cH2O。要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称量样品的质量;②高温分解;③测出CO2的质量;④测出水蒸汽的质量;⑤称量CuO的质量。而乙同学认为除步骤②外,实验只需测定四个量中的三个即可,则合理的组合为?(填序号,写一组即可)。
参考答案:(15分,除注明外每空2分)
(1)Fe(OH)3 ;?(2)3.2~4.2;? d;?(3)CuO(名称亦可);
(4)①Cu2++CO32-=CuCO3↓;②Cu2++CO32-+H2O= Cu(OH)2↓+ CO2↑;
(5)①③④(或①③⑤、①④⑤)(3分)
本题解析:(1)对比原料和目标产物的成分,可以猜测该流程各个步骤的主要目的,反应A是为了氧化亚铁离子,调节pH是为了使铁离子全部变为氢氧化铁沉淀,过滤是为了除去铁元素,因此滤渣的主要成分是Fe(OH)3,反应B是制取碱式碳酸铜,第二次过滤是为了除去可溶性盐;(2)读表中信息,根据流程中原料和目标产物的组成,调节溶液pH时,应使铁离子完全沉淀,而铜离子不能开始沉淀,因此溶液pH应介于3.2~4.2之间;若选择氨水,会引入铵根离子等杂质,故a选项错误;若选择稀硫酸,会引入硫酸根离子等杂质,故b选项错误;若选择氢氧化钠,会引入钠离子等杂质,故c选项错误;若选择碳酸铜,不仅能除去杂质,而且引入的铜离子能增大目标产物的量,故d选项正确;(3)若反应B的温度过高,产生的碱式碳酸铜可能分解生成黑色的氧化铜固体,使制备的目标产物不纯;(4)碳酸根离子与铜离子结合生成碳酸铜沉淀,即Cu2++CO32-=CuCO3↓;铜离子与碳酸根离子发生双水解反应,生成氢氧化铜沉淀和二氧化碳气体,即Cu2++CO32-+H2O= Cu(OH)2↓+ CO2↑;(5)碱式碳酸铜高温分解的原理为:aCuCO3?bCu(OH)2?cH2O  (a+b)CuO+(b+c)H2O↑+aCO2↑,由于各物质的摩尔质量数值上等于式量,n=m/M,该反应中碱式碳酸铜、氧化铜、水蒸气、二氧化碳的系数之比等于物质的量之比,只需要进行①③④(或①③⑤、①④⑤)实验,就可以计算出碱式碳酸铜的组成中a、b、c的值。
(a+b)CuO+(b+c)H2O↑+aCO2↑,由于各物质的摩尔质量数值上等于式量,n=m/M,该反应中碱式碳酸铜、氧化铜、水蒸气、二氧化碳的系数之比等于物质的量之比,只需要进行①③④(或①③⑤、①④⑤)实验,就可以计算出碱式碳酸铜的组成中a、b、c的值。
本题难度:一般
5、实验题 (10分) 硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2 ~ 3遍;②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50 ~ 80℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2 ~ 3次,再用滤纸将晶体吸干;⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。请回答下列问题:
(1)写出Fe2+的核外电子排布式?
(2)用轨道表示式表示Fe3+的3d电子的排布情况?
(3)硫酸亚铁制备中实验步骤①的目的是? ?。
(4)实验步骤②明显不合理,理由是?。
(5)实验步骤④中用少量冰水洗涤晶体,其目的是?。
参考答案:(1)[Ar]3d6?(2)?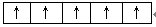 (3)除去铁屑上的油污?
(3)除去铁屑上的油污?
(4)Fe不能反应完全,余少部分防止Fe2+被氧化成Fe3+?
(5)?洗涤晶体中混有的稀硫酸,减少洗涤过程中晶体的损耗(2分×5)
本题解析:(1)根据构造原理可写出Fe2+的核外电子排布式为[Ar]3d6。
(2)洪特规则电子总是优先占据1个轨道,并且自旋方向相同,所以Fe3+的3d电子的排布情况是 。
。
(3)碳酸钠溶液显碱性,可以除去铁屑上的油污。
(4)亚铁离子易被氧化生成铁离子,所以必须让铁过量,防止Fe2+被氧化成Fe3+。
(5)晶体表面会吸附溶液中的稀硫酸,所以用水洗涤晶体中混有的稀硫酸,减少洗涤过程中晶体的损耗。
本题难度:一般