微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验能达到相应目的的是
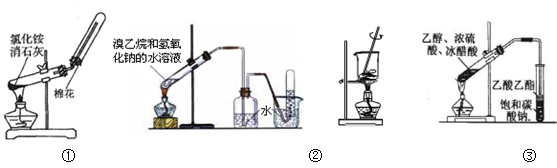
A.用图①装置制取并收集氨气
B.用图②装置制取和收集乙烯
C.用图③装置将海带灼烧成灰
D.用图④装置制取乙酸乙酯
参考答案:D
本题解析:A、实验室制取氨气时,因为有水生成,所以发生装置的试管应向下倾斜,错误;B、溴乙烷与氢氧化钠的水溶液发生取代反应,得到的是乙醇,不是乙烯,错误;C、灼烧海带应在坩埚中进行,错误;D、乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的溶解度小,所以用饱和碳酸钠吸收,正确,答案选D。
本题难度:一般
2、填空题 “烂板液”是制印刷锌板时,用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子。在实验室中由“烂板液”制取ZnSO4·7H2O的过程如下:

已知有关金属离子形成氢氧化物沉淀时的pH见下表:
离子
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe3+
| 1.9
| 3.2
|
Zn2+
| 6.4
| 8.0
|
(1)沉淀B的主要成分是?。
(2)第②步操作中需要的玻璃仪器有?。
(3)第④步中pH应保持在?范围内。
(4)第⑥步调节溶液pH=2的目的是?。
(5)操作⑦包含3个基本实验操作,它们是蒸发浓缩、?和过滤。
参考答案:⑴Fe(OH)3?⑵漏斗、玻璃棒、烧杯?⑶3.2~6.4?⑷抑制Zn2+水解
⑸冷却结晶(或降温结晶)
本题解析:略
本题难度:简单
3、填空题 (10分)某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)取样品a g。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有的金属阳离子为________;滤渣中含有的物质为____________;
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中与铝的化合物有关的离子方程式_____________________________。
(4)在第(3)步的滤液中通入足量CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至重量不再减少为止,冷却后称量,质量为b g。写出足量CO2通入滤液中所涉及的化学方程式________________。
(5)计算:该样品中铝的质量分数的表达式为___________________________。
参考答案:(10分) 1.(2)Mg2+、Al3+ (2分)? Cu、Si (2分)
(3) Al3++3OH-===Al(OH)3↓,Al(OH)3+OH-===AlO2-+2H2O
或Al3++4OH-=AlO2-+2H2O?(2分)
(4)NaAlO2+CO2+2H2O===NaHCO3+Al(OH)3↓?(2分)(5) 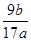 ×100%?(2分)
×100%?(2分)
本题解析:(2)单质铜和硅与盐酸不反应,所以将样品溶于足量稀盐酸中,过滤,滤液中主要含有的金属阳离子为Mg2+、Al3+,滤渣中含有的物质为Cu、Si。
(3)由于氢氧化铝是两性氢氧化物,所以往滤液中加入过量NaOH溶液,生成氢氧化镁白色沉淀,而铝离子先生成氢氧化铝白色沉淀,然后又溶解,反应的离子方程式分别是Al3++3OH-===Al(OH)3↓,Al(OH)3+OH-===AlO2-+2H2O或Al3++4OH-=AlO2-+2H2O。
(4)偏铝酸钠能和CO2反应生成氢氧化铝白色沉淀,由于CO2过量,所以反应的化学方程式是NaAlO2+CO2+2H2O===NaHCO3+Al(OH)3↓。
(5)最终生成的是氧化铝,质量是bg,则根据原子守恒可知,该样品中铝的质量分数的表达式为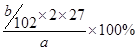 =
=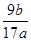 ×100%。
×100%。
点评:该题是中等难度的试题,试题贴近高考,难易适中,注重能力的培养和解题方法的训练,注重解题的灵活性。有利于培养学生的逻辑推理能力和发散思维能力,提高学生分析问题、解决问题的能力。有助于提高学生的应试能力和灵活应变能力。
本题难度:一般
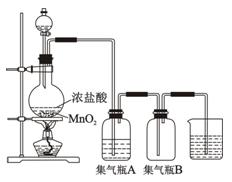
4、实验题 实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
试回答下列问题:
(1)该反应是氧化还原反应吗?①?(填“是”或“不是”),如果是氧化还原反应,指出②氧化剂是?,③还原剂是?,④写出该反应的离子 方程式?。
方程式?。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯
化氢在饱和食盐水中的溶解度则很大),其作用是?。
(3)氯气溶于水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中
毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用?溶液来吸收有毒的氯气。
(4)一次实验中,加入浓盐酸200mL,其密度为1.19g·cm-3、HCl的质量分数为36.5%,
当MnO2刚好完全反应时,产生了5.6L(标准状况)的氯气。
试计算该浓盐酸的物质的量浓度和被氧化的HCl的物质的量。(请写出计算过程)
参考答案:(1)① 是;② MnO2;③ 浓盐酸;
④ 4H ++2Cl-+MnO2
++2Cl-+MnO2 Cl2↑+Mn2++2H2O;
Cl2↑+Mn2++2H2O;
( 2)除去氯气中混有的HCl气体 (3)浓氢氧化钠(浓碱)
2)除去氯气中混有的HCl气体 (3)浓氢氧化钠(浓碱)
(4)(计算过程略)浓盐酸的物质的量浓度是:11.9 mol/L
被氧化的HCl的物质的量为: 0.5mol
本题解析:略
本题难度:简单
5、选择题 实验室制备下列气体,通常只能用排水法收集的是
[? ]
A.NO2
B.NO
C.CO
D.Cl2
参考答案:BC
本题解析:
本题难度:简单