微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把4.48L CO2通过一定量的固体过氧化钠后收集到3.36L气体(气体的测量均在标准状况下),则这3.36L气体的质量是( )
A.6.0g
B.5.6g
C.4.8g
D.3.8g
参考答案:令参加反应的CO2气体的体积为a,生成的O2的体积为b,则:
2CO2+2Na2O2=Na2CO3+O2,气体体积减小△V
2? 1? 1
a?b?4.48L-3.36L=1.12L
解得:a=2.24L,b=1.12L,
生成氧气的体积1.12L,小于3.36L,故二氧化碳有剩余,
所以:3.36L气体中CO2体积为4.48L-2.24L=2.24L,O2的体积为1.12L,
所以4.48L气体的质量为2.24L22.4/mol×44g/mol+1.12L22.4L/mol×32g/mol=6.0g.
故选A.
本题解析:
本题难度:一般
2、选择题 关于氧化还原反应的说法中正确的是
A.氧化还原反应的本质是电子得失或偏移
B.失去电子的物质是氧化剂
C.原子得到电子后,元素的化合价一定升高
D.化合反应一定是氧化还原反应
参考答案:A
本题解析:失去电子的物质是还原剂,故B错误;
原子得到电子后,元素的化合价降低,故C错误;
无化合价变化的化合反应不是氧化还原反应,故D错误;
本题难度:一般
3、计算题 (10分)将1.52g铜镁合金完全溶解于50.0mL密度为1.40g/mL、质量分数为63.0%的浓硝酸中,得到NO2和N2O4的混合气体1120mL (标准状况),向反应后的溶液中加入1.00mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
(1)浓硝酸中HNO3的物质的量浓度。
(2)该合金中铜与镁的物质的量之比为 。
(3) NO2和N2O4的混合气体中,NO2的体积分数是 。
参考答案:(1)C(HNO3)=14mol/L;(2)2:1;(3)80%
本题解析:(1)根据金属的物质的量浓度与质量分数的换算关系可知:C="(ρ×1000×ω)÷M" ="(1.40×1000×63.0%)" ÷63=14mol/L;在化学反应中金属失去的电子的物质的量等于硝酸得到的电子的物质的量等于形成沉淀时的氢氧根离子的物质的量。铜镁都是+2价的金属,金属增加的质量就是OH-的质量。m(OH-)= 2.54g-1.52g=1.02g。n(OH-)=1.02g÷17g/mol=0.06mol.则n(Mg)+n(Cu)=0.03mol.因为24 n(Mg)+64n(Cu)= 1.52。n(Mg)="0.01mol;" n(Cu)=0.02mol.所以该合金中铜与镁的物质的量之比为0.02:0.01=2:1.(3)1120mL混合气体的物质的量是0.05mol。假设NO2和N2O4的混合气体中,NO2的物质的量是x,则N2O4的物质的量是(0.05-x)mol.根据电子守恒可得x+2(0.05-x)= 0.06mol.解得x=0.04mol.对于气体来说,气体的体积比等于它们的物质的量的比。所以NO2的体积分数是(0.04mol÷0.05mol)×100%=80%。
考点:考查守恒法在氧化还原反应中的应用的知识。
本题难度:一般
4、选择题 属于置换反应的是? (? )?
A.CaCO3 + 2HCl= CaCl2 + H2O + CO2↑
B.SiO2+CaO CaSiO3
CaSiO3
C.N2+3H2 2NH3
2NH3
D.2Mg+CO2 2MgO+C
2MgO+C
参考答案:D
本题解析:一种单质和一种化合物反应生成另一种单质和另一种化合物的反应属于置换反应。A是复分解反应,B和C是化合反应,所以答案选D。
本题难度:简单
5、选择题 在2Cu(NO3)2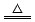 2CuO+4NO2↑+O2↑反应中,被氧化的元素是
2CuO+4NO2↑+O2↑反应中,被氧化的元素是
A.Cu
B.N
C.O
D.Cu和O
参考答案:C
本题解析:略
本题难度:一般