微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是
A.该物质属于两性氢氧化物
B.该物质是Al(OH)3和Na2CO3的混合物
C.1 mol NaAl(OH)2CO3最多可消耗3 mol H+
D.该药剂不适合于胃溃疡患者服用
参考答案:D
本题解析:A、该物质中含有CO32-,因此该物质不属于两性氢氧化物,A不正确;B、该物质是纯净物,B不正确;C、该物质能电离出2个OH-与1个CO32-,因此与酸反应最多可消耗4 mol H+,C不正确;D、双羟基铝碳酸钠是医疗上常用的一种抑酸剂,但与酸反应会产生CO2气体,所以该药剂不适合于胃溃疡患者服用,D正确,答案选D。
本题难度:一般
2、填空题 铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:

已知:
(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中发生反应的离子方程式:?。
(2)滤渣A的主要成分为?;滤渣A的用途是?(只写一种);实验室过滤时使用玻璃棒,其作用是?。
(3)在工艺流程第三步中,选用二氧化碳作酸化剂的原因是?。
(4)若将铝溶解,下列试剂中最好选用?(填编号)。
A.浓硫酸 ?B.稀硫酸 ?C.稀硝酸
理由是?。
参考答案:(1)Al2O3+2OH-=2AlO2-+H2O?SiO2+2OH-=SiO32-+H2O
(2)Fe2O3、Na2Al2Si2O8炼铁的原料(或生产硅酸盐产品的原料) 引流
(3)经过足量氢氧化钠溶液的溶解,大部分铝元素均以NaAlO2的形式存在于滤液中,通入过量二氧化碳可以将NaAlO2完全转化为Al(OH)3
(4)B 铝与浓硫酸在常温下发生钝化,加热溶解会产生有毒气体SO2,原料利用率低;稀硝酸能溶解铝但会产生NO气体,污染空气,硝酸利用率低;而铝与稀硫酸反应速率较快,产生的H2对空气无污染。
本题解析:(1)Al2O3属于两性氧化物,SiO2属于酸性氧化物,都能与强碱反应。
(2)利用题目给出的信息——“硅铝酸盐沉淀”,可以知道滤渣A的主要成分是Fe2O3、Na2Al2Si2O8。对于滤渣A的用途一般很容易想到其可以作为炼铁的原料。
(3)因为Al(OH)3是两性氢氧化物,若用强酸酸化滤液时,无法保证将全部铝元素转化为Al(OH)3过滤出来。
(4)分析问题时,一般要同时考虑生产效益(原料利用率)和环保问题。
本题难度:一般
3、实验题 (8分)某学习小组用下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.

(提示:镁、铝均与酸反应,铝还能和碱反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑)
实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是除去铝镁合金表面的氧化膜。
(1)A中试剂为?.
(填“NaOH溶液”或“稀盐酸”)
(2)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录
C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温;④由A向B中滴加足量试剂;⑤检查气密性;⑥调整橡胶软管使D和C的液面相平。
上述操作的顺序是?;(填序号)
(3)B中发生反应的离子方程式为? .
(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将?.
(填“偏大”、“偏小”、“不受影响”)
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b ml(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为?.(用含a、b、c的代数式表示)
参考答案:(8分)
(1)NaOH溶液.(1分)
(2)①④③⑥①②(2分);
(3)2Al+2OH-+2H2O=2AlO2- +3H2↑(2分)
(4)偏小. (1分)
(5)33600(a-c)/b (2分)
本题解析:略
本题难度:一般
4、填空题 Al及其化合物在工业上有极其广泛的用途,
(1)焊接钢轨时用Al冶炼Fe的反应方程式为?;铝的化合物明矾可用于净水,其原理用离子方程式解释为?。
(2)硅藻遗骸中主要成分是Al2O3、SiO2和Fe2O3。从中获取Al(OH)3的过程如下:
步骤I:取适量硅藻遗骸用70%H2SO4浸泡;
步骤II:向上述浸泡液中加入过量NaOH并过滤;
步骤III:向上述滤液中通入过量CO2过滤得到Al(OH)3。
①用70%H2SO4浸取硅藻遗骸的目的是?。
②步骤II中涉及铝元素的离子方程式为?;
③步骤III中能否用HCl代替CO2??(填“能”或“不能”);该步骤所得滤液中存在的电荷守恒式为?;向该滤液中滴加少量NaOH溶液,则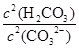 ?填(“变大”、“变小”或“不变”)
?填(“变大”、“变小”或“不变”)
(3)Al(OH)3可用作阻热材料,试从Al(OH)3的化学性质角度分析其原因?。
参考答案:
(1)Fe2O3+2Al Al2O3+2Fe(2分)? Al3++3H2O=Al(OH)3(胶体)+3H+(2分)
Al2O3+2Fe(2分)? Al3++3H2O=Al(OH)3(胶体)+3H+(2分)
(2)①从硅藻遗骸中浸取出Al3+和Fel3+(1分)
②Al3++4OH-=AlO2-+2H2O(或Al3++3OH-=Al(OH)3↓? Al(OH)3+OH-=AlO2-+2H2O)( 2分)
③不能(1分) c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+2c(SO42-)(2分)?变小(1分)
(3)Al(OH)3的分解反应为吸热反应
本题解析:本题是通过工业上Al及其化合物在工业上的用途以及Al(OH)3的分离与制备。
(1)一个是铝热反应的用途—焊接钢轨或者用来冶炼金属,可溶性铝盐净水,主要是利用Al3+的水解
得到Al(OH)3(胶体)吸附悬浮物达到净水的目的。Fe2O3+2Al Al2O3+2Fe,Al3++3H2O=Al(OH)3(胶体)+3H+。这两个方程式注意条件,前面是高温,后面需注意用“=”号并且要写 “胶体”二字。
Al2O3+2Fe,Al3++3H2O=Al(OH)3(胶体)+3H+。这两个方程式注意条件,前面是高温,后面需注意用“=”号并且要写 “胶体”二字。
(2) 通过从Al2O3、SiO2和Fe2O3中获取Al(OH)3:用H2SO4浸泡溶解Al2O3和Fe2O3,剩余SiO2,然后进行过滤得到固体(SiO2)和滤液(Al3+和Fel3+,SO42-等)。然后向上述浸泡液中加入过量NaOH后得到Fe(OH)3↓和NaAlO2和NaOH的混合溶液并进行过滤。在往上述滤液中通入过量CO2过滤得到Al(OH)3↓和NaHCO3溶液。
①用70%H2SO4浸取硅藻遗骸的目的是使Al2O3、Fe2O3溶解,从硅藻遗骸中浸取出Al3+和Fel3+
②步骤II中涉及铝元素的离子方程式为Al3++4OH-=AlO2-+2H2O(或Al3++3OH-=Al(OH)3↓? Al(OH)3+OH-=AlO2-+2H2O),Al3+与OH-的反应与量有关。
③步骤III中不能用HCl代替CO2;HCl不好控制用量,HCl过量Al(OH)3↓会溶解,HCl少量,AlO2-不能完全沉淀。该步骤所得滤液中存在的离子有:阳离子:Na+、 H+?阴离子:CO32-、HCO3-、OH-、SO42-。根据电荷守恒即有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+2c(SO42-)。向该滤液中滴加少量NaOH溶液,消耗H2CO3、CO32-增大,所以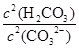 =
=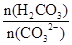 比值变小
比值变小
(3)Al(OH)3可用作阻热材料,利用Al(OH)3受热分解,使温度降低。3的分离与制备,物质分离,方程式书写等结合在一起考查
本题难度:一般
5、填空题 用电除尘法可除去火力发电厂烟囱中大量的粉煤灰。已知粉煤灰的主要成分如下表,从粉煤灰中能够获得Al2O3。某校研究性学习小组设计了如图所示的提取Al2O3的工艺流程图。

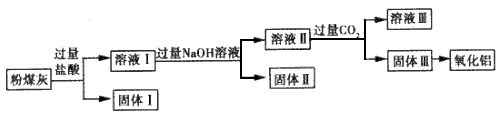
请回答下列问题。
(1)上述氧化物中能与NaOH溶液反应的是___。
(2)①固体I中含有的主要物质的化学式为__。
②向溶液Ⅱ中通人过量的CO2,发生反应的离子方程式为___。
(3)电解氧化铝制备金属铝时常常需加入冰晶石,冰晶石的作用是___,电解氧化铝的化学方程式为________,理论上从1t粉煤灰中可得到铝的质量为__。
参考答案:(1)SiO2.SO2和Al2O3
(2)①SiO2 ;
②OH-+CO2=HCO3-、? AlO2-+2H2O+CO2=Al(OH)3↓ +HCO3-
(3)使氧化铝在较低的温度下熔化;2Al2O3(熔融) 4Al+3O2↑? ;0.153 t
4Al+3O2↑? ;0.153 t
本题解析:
本题难度:一般