微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应 2A(g)+B(g)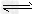 2C(g),若经2s后测得?C的浓度为0.6mol/L,计算:
2C(g),若经2s后测得?C的浓度为0.6mol/L,计算:
(1)2s时B的浓度,A的速率
(2)A的转化率?
参考答案:(1)0.7mol/L;0.3mol/(L·s)?
(2)30%
本题解析:
本题难度:一般
2、填空题 工业上制取三氧化硫反应的热化学方程式为:
2SO2(g)十O2(g) 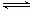 2SO3(g)?△H=-198kJ·mol-1
2SO3(g)?△H=-198kJ·mol-1
(1)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是?(填序号)。
A.每生成1mol SO3的同时生成0.5mol O2
B.容器中混合气体的密度不变
C.SO2、O2、SO3的物质的量之比为2:1:2
D.容器中气体总压强不变
(2)400℃,1.01×105Pa下,上述反应中n(SO3)和n(O2)随时间变化的关系如图所示。下列叙述正确的是?(填序号)。
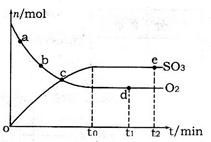
A.点a的正反应速率比点b的大
B.点c处反应达到平衡状态
C.点d和点e处的n(O2)相同
D.500℃,1.01×105Pa下,反应达到平衡时,n(SO3)比图中e点的值大
(3)已知该反应的K(400℃)=7200mol-1·L。在400℃时,容积为1.0L的密闭容器中充入0.05mol SO2(g)和0.03mol O2(g),反应一段时间后,有0.04mol SO3生成。此时,该反应?(填“是”、“否”或“无法判断”)达到化学平衡状态,理由是?。
参考答案:(1)AD(2分)(2)AC(2分)
(3)否(2分),400℃时,浓度熵Q=1600mol-1·L,而K(400℃)=7200mol-1·L,Q<K,反应没有达到平衡状态;(2分)
本题解析:(1)A、每生成1mol?SO3的同时生成0.5mol?O2,说明正逆反应速率相等,反应达到平衡状态,故A正确;B、容器是恒容的,无论反应是否达到平衡状态,混合物的质量始终不变,容器的体积不变,导致密度始终不变,所以不是达到平衡状态的标志,故B错误;C、SO2、O2与SO3的物质的量之比为2:1:2,这与反应的初始物质的量以及反应的转化程度有关,不能确定是否达到平衡,故C错误;D、该反应是一个反应前后气体体积改变的化学反应,当反应达到平衡状态时,各物质的量不变,导致容器中压强不随时间的变化而改变,故D正确;故选:AD;
(2)A.反应物浓度越大,反应速率越快,故a点时刻的正反应速率比b点时刻的大,故A正确;B.a、b、c三点未到达平衡状态,反应向正反应进行,故B错误;C.d、e两点处于平衡状态,温度相同,C(O2)相等,n(O2)相同,故C正确;D.该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡时三氧化硫的物质的量减小,故D错误;故答案为:AC;
(3)? 2SO2(g)十O2(g)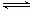 2SO3
2SO3
起始(mol/L)?0.05?0.03? 0?
反应(mol/L)?0.04?0.02?0.04
一段时间后(mol/L)0.01? 0.01? 0.04
400℃时,浓度熵Q=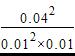 =1600mol-1·L>K(400℃)=7200mol-1·L,反应没有达到平衡。
=1600mol-1·L>K(400℃)=7200mol-1·L,反应没有达到平衡。
本题难度:困难
3、选择题 反应4A(s)+3B(g)==2C(g)+D(g),2min后B的浓度减小0.6mol/L。对此反应速率的不正确表示是
[? ]
A.用A表示的反应速率是0.4mol/(L·min)
B.用B、C、D分别表示反应的速率,其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3mol/(L·min)
D.在2min内的反应速率,用D表示是0.1mol/(L·min)
参考答案:AC
本题解析:
本题难度:简单
4、选择题 在t℃向一密闭容器中放入1mol A 和1 mol B发生反应:A(固) + B(气) C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是
C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是
A.2molA和1molB
B.2molD和1mol A 和 1molB
C.1molC和2molD 和1molB
D.1molC和1molD
参考答案:A
本题解析:所谓等效平衡是指外界条件相同时,同一可逆反应只要起始浓度相当,无论经过何种途径,都可以达到相同的平衡状态。等效平衡的判断及处理一般步骤是:进行等效转化——边倒法,即按照反应方程式的计量数之比转化到同一边的量,与题干所给起始投料情况比较。等效平衡一般有三种类型:I类:恒温恒容下对于反应前后气体体积发生变化的反应来说(即△n≠0的体系):等效转化后,对应各物质起始投料的物质的量与原平衡起始态相同。II类:恒温恒容下对于反应前后气体体积没有变化的反应来说(即△n=0的体系):等效转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。III类:恒温恒压下对于气体体系等效转化后,要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。由于反应物A是固体,所以改变固体的质量不会影响平衡状态,A正确;B中B中开始有生成物D存在,不正确;C中相对于是2molB,不正确;D中换算后,仍然存在生成物,不正确,答案选A。
点评:该题是中等难度的试题,对学生的要求较高,不易得分。解答该类型试题的关键是分清等效平衡的类别,用相应的方法求解即可
本题难度:一般
5、选择题 下列叙述中,不能用平衡移动原理解释的是
A.红棕色的NO2,加压后颜色先变深后变浅
B.黄绿色的氯水光照后颜色变浅
C.由H2、Br2(g)、HBr(g)气体组成的平衡体系加压后颜色变深
D.工业合成氨反应中加压有利于提高氨气的产率
参考答案:C
本题解析:A. 2NO2(红棕色) N2O4(无色)。加压后由于单位体积内的NO2分子数增多,所以颜色加深。增大压强,根据平衡移动原理,可逆反应向气体体积减小的方向即正反应方向移动,又使NO2的浓度又有所减小。与题目要求不符。错误。B.氯气溶于水发生反应:Cl2+H2O
N2O4(无色)。加压后由于单位体积内的NO2分子数增多,所以颜色加深。增大压强,根据平衡移动原理,可逆反应向气体体积减小的方向即正反应方向移动,又使NO2的浓度又有所减小。与题目要求不符。错误。B.氯气溶于水发生反应:Cl2+H2O H++Cl-+HClO光照发生2HClO
H++Cl-+HClO光照发生2HClO 2HCl+O2↑由于减小了生成物HClO的浓度,破坏了可逆反应的平衡,减小生成物的浓度,平衡向正反应方向移动,不断消耗氯气,使黄绿色的氯水后颜色逐渐变浅。不符合题目要求。错误。C.反应H2+Br2(g)
2HCl+O2↑由于减小了生成物HClO的浓度,破坏了可逆反应的平衡,减小生成物的浓度,平衡向正反应方向移动,不断消耗氯气,使黄绿色的氯水后颜色逐渐变浅。不符合题目要求。错误。C.反应H2+Br2(g) 2HBr(g)是应该反应前后气体体积相等的反应。当给该平衡体系加压后由于各物质的浓度都增大颜色变深。但增大压强化学平衡不发生移动。符合题意。正确。D.工业合成氨反应N2+3H2
2HBr(g)是应该反应前后气体体积相等的反应。当给该平衡体系加压后由于各物质的浓度都增大颜色变深。但增大压强化学平衡不发生移动。符合题意。正确。D.工业合成氨反应N2+3H2  2NH3的正反应是个气体体积减小的反应。增大压强,化学平衡向气体体积减小的方向即正反应方向移动。产生更多的NH3。故加压可提高NH3的产率。,不符合题意。错误。
2NH3的正反应是个气体体积减小的反应。增大压强,化学平衡向气体体积减小的方向即正反应方向移动。产生更多的NH3。故加压可提高NH3的产率。,不符合题意。错误。
本题难度:一般