微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)  xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________
(2)A的转化率为_________________
(3)生成D的反应速率为_________________
(4)如果增大反应体系的压强,则平衡体系中C的质量分数_________(填变大、变小、不变)
(5)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各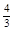 mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol
mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol
参考答案:(10分)每空2分?(1)2? (2)60%? (3)0.2 mol/(L?min)? (4) 不变(5)B? 4/3
本题解析:考查可逆反应的有关计算。
(1)平衡时生成C的物质的量是1.4mol/L×2L=0.8mol。根据变化量之比是相应的化学计量数之比可知,x=2。
(2)根据方程式可知,生成0.8molD,则消耗A是1.2mol,所以A的转化率是1.2÷2×100%=60%。
(3)反应速率通常用单位时间内浓度的变化量来表示,所以D的反应速率是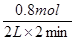 =)0.2 mol/(L?min)。
=)0.2 mol/(L?min)。
(4)根据方程式可知,由于反应前后体积是不变的,所以改变压强平衡是不移动的,因此C的含量是不变的。
(5)要满足平衡等效,则根据方程式换算之后,A和B的物质的量与最初的物质的量应该是相等的,所以C和D各是4/3mol,根据方程式可知,就相当于A是2mol、B是2/3mol,所以还需要在加入2mol-2/3mol=4/3mol的B物质。
本题难度:一般
2、选择题 下列四个图像所反映的内容与相应反应符合的是(a、b、c、d均大于0)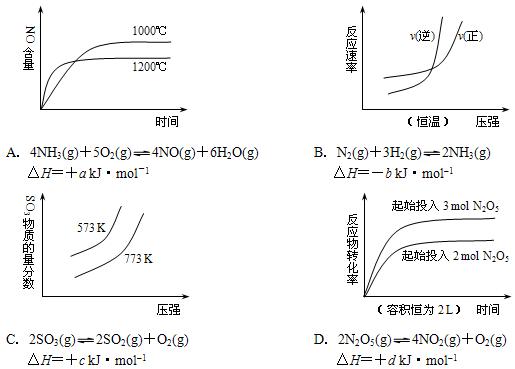
参考答案:C
本题解析:略
本题难度:一般
3、填空题 煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO (g) +H2O (g) H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:

回答下列问题
(1)该反应的平衡常数表达式K=?,ΔH=?0(填“<”、“>”、“=”)
(2)已在一定温度下,C(s) +CO2 (g) 2CO (g)平衡常数K1;
2CO (g)平衡常数K1;
C (s) +H2O(g) CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是?:
CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是?:
(3)8000C时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时间后反应达到平衡,此时CO的转化率为?:若保持其他条件不变,向平衡体系中再通入0. 10molCO和0.40molCO2,此时v正?v逆 (填“>”、“=”或“<”)。
参考答案:(7分)(1) C(CO2)C(H2)/C(CO) C(H2O),(1分) ,< (1分);
(2) K=K2/K1?(1分)?(3)80% (2分);=(2分)
本题解析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数表达式K=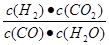 。根据表中的数据可知,随着温度的升高,平衡常数K是减小的,这说明升高温度平衡向逆反应方向进行,所以正方应是放热反应,即△H<0。
。根据表中的数据可知,随着温度的升高,平衡常数K是减小的,这说明升高温度平衡向逆反应方向进行,所以正方应是放热反应,即△H<0。
(2)根据盖斯定律可知,②-①即得到反应CO (g) +H2O (g) H2 (g) +CO2 (g),所以平衡常数之间的关系是K=K2/K1。
H2 (g) +CO2 (g),所以平衡常数之间的关系是K=K2/K1。
CO (g) +H2O (g) H2 (g) +CO2 (g)
H2 (g) +CO2 (g)
起始浓度(mol/L)? 0.040? 0.16? 0? 0
转化浓度(mol/L)? x? x? x? x
平衡浓度(mol/L)? 0.040-x? 0.16-x? x? x
则根据该温度下的平衡常数可知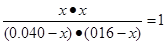
解得x=0.032mol/L
所以CO的转化率=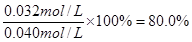
若保持其他条件不变,向平衡体系中再通入0. 10molCO和0.40molCO2,则此时CO、H2O、CO2、H2的浓度分别是(mol/L)0.018、0.128、0.072、0.032,所以Q=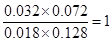 ,所以反应仍然是平衡状态,则正逆反应速率相等。
,所以反应仍然是平衡状态,则正逆反应速率相等。
点评:该题是中等难度的试题,也是高考中的常见题型。试题针对性强,主要是考查学生对平衡常数含义、表达式以及有关应用的熟悉了解程度,旨在培养学生的逻辑思维能力和规范答题能力。在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。
本题难度:一般
4、填空题 开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)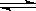 CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
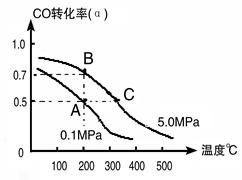
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=?;
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA?tC(填“大于”、“小于”或“等于”)。
③工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是:?。
(2)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
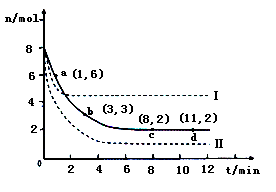
①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是??,曲线Ⅱ对应的实验条件改变是?。
(3)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-1gc(Clˉ)]
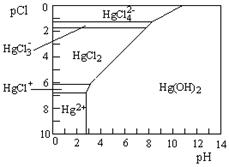
①下列说法中正确的是?。
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释
B.当c(C1ˉ) =10ˉ1 mol·Lˉ1时,汞元素一定全部以HgCl42ˉ形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl+ + C1ˉ
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是?(填晶体类型)。
参考答案:(1)①K="0.25" (2分)?②大于(2分) ③原料易得、可以减轻温室效应等(2分)
(2)①(2分)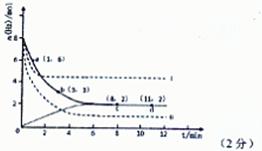
②?升温, 增压(各1分)
(3)①AD?②分子晶体
本题解析:(1)①?2CO(g)+4H2(g)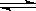 CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)
起始浓度(mol/L) 1? 2? 0? 0
转化浓度(mol/L)0.5? 1.0? 0.25? 0.25
平衡浓度(mol/L)0.5? 1.0? 0.25? 0.25
根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知,该温度下反应的平衡常数K=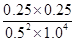 =0.25。
=0.25。
②根据图像可知,C点温度和压强均大于A点温度和压强,所以C点反应速率快,达到平衡的时间少。
③由于氮气中CO2的含量逐渐增大,所以该方法的优点是原料易得、可以减轻温室效应。
(2)①根据图像可知平衡时氢气的物质的量是2mol,消耗氢气的物质的量是8mol-2mol=6mol,所以根据方程式可知平衡时生成甲醇的物质的量是2mol,因此图像可表示为见答案。
②曲线I与原曲线相比达到平衡的时间减少,说明反应速率快。而平衡时氢气的物质的量增加,说明平衡向逆反应方向移动。由于正方应是体积减小的可逆反应,所以改变的条件只能是升高温度,即正方应是放热反应;曲线Ⅱ与原曲线相比达到平衡的时间减少,说明反应速率快。而平衡时氢气的物质的量减少,这说明平衡向正反应方向移动。由于正方应是体积减小的放热的可逆反应,所以改变的条件只能是增大压强。
(3)①A.Hg2+水解溶液显酸性,所以为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释,A正确;B.当c(C1ˉ) =10ˉ1 mol·Lˉ1即pCl=1时,汞元素主要是以HgCl42ˉ形式存在,B不正确;C.HgCl2是一种弱电解质,其电离方程式是:2HgCl2 HgCl+ + HgCl3ˉ,C不正确;D.根据图像可知当溶液pH保持在4,pCl由2改变至6时,可使HgC l2转化为Hg(OH)2,D正确,答案选AD。
HgCl+ + HgCl3ˉ,C不正确;D.根据图像可知当溶液pH保持在4,pCl由2改变至6时,可使HgC l2转化为Hg(OH)2,D正确,答案选AD。
②HgCl2又称“升汞”,熔点549K,加热能升华,这说明晶体是分子晶体。
本题难度:困难
5、选择题 对于达到化学平衡状态的可逆反应:N2 + 3H2 ?2NH3 + Q,下列叙述中正确的?
?2NH3 + Q,下列叙述中正确的?
A.反应物和生成物的浓度相等
B.反应物和生成物的浓度不再变化
C.降低温度,平衡混合物中NH3的浓度减小
D.增大压强,不利于氨的合成
参考答案:B
本题解析:达到化学平衡状态时反应物和生成物的浓度不再变化,并不一定是反应物和生成物的浓度相等,A错,B正确;反应放热,降低温度,平衡向正向移动,混合物中NH3的浓度最大,C错;增大压强,平衡向正向移动,有利于氨的合成,D错。
本题难度:一般