微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,不可能与NaHCO3溶液反应生成气体的物质是
A.酸
B.碱
C.盐
D.氧化物
参考答案:B
本题解析:分析:根据能与NaHCO3溶液反应并放出气体的溶液为酸性来回答.
解答:A、酸如盐酸能与NaHCO3反应:HCl+NaHCO3=NaCl+CO2↑+H2O,故A正确;
B、NaHCO3溶液与碱如NaOH溶液反应:NaHCO3+NaOH=Na2CO3+H2O,无气体放出,故B错误;
C、NaHSO4溶液呈酸性,属于盐类,能与NaHCO3反应:NaHSO4+NaHCO3=Na2SO4+CO2+H2O,故C正确;
D、NaHCO3溶液与氧化物(三氧化硫或是二氧化氮反应),如向NaHCO3溶液中加入三氧化硫,发生反应:H2O+SO3+2NaHCO3=Na2SO4+2CO2↑+2H2O,故D正确;
故选B.
点评:本题主要考查了酸式盐的性质,酸式盐既可以与酸反应也可以与碱反应,但硫酸氢盐为强酸的酸式盐只能与碱反应,溶液显酸性.
本题难度:简单
2、选择题 9.2g金属钠投入到足量的重水中,则产生的气体中含有
A.0.2?mol中子
B.0.4?mol电子
C.0.2?mol质子
D.0.4?mol分子
参考答案:B
本题解析:分析:根据反应2Na+22H2O=2NaO2H+2H2↑,n(Na)=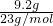 =0.4mol,结合化学方程式和原子的构成计算.
=0.4mol,结合化学方程式和原子的构成计算.
解答:n(Na)=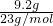 =0.4mol,
=0.4mol,
反应方程式为2Na+22H2O=2NaO2H+2H2↑,
生成n(2H2)=0.2mol,则
A.中子为0.2mol×2=0.4mol,故A错误;
B.电子为0.2mol×2=0.4mol,故B正确;
C.质子为0.2mol×2=0.4mol,故C错误;
D.分子为0.2mol.故D错误.
故选B.
点评:本题考查化学反应的计算,题目难度不大,本题要特别注意把握原子的构成.
本题难度:简单
3、选择题 将绿豆大小的方形金属钠投入足量且含酚酞的水中,根据相应现象不能得出的结论是
A.A
B.B
C.C
D.D
参考答案:A
本题解析:分析:钠与水反应放出的热能使本身熔化成闪亮的小球,说明熔点低,浮在水面,说明密度比水小,加入酚酞的液体变红,说明生成了碱性物质,钠和水反应生成的气体使小球四处游动.
解答:A.钠和水反应变成小球,说明钠的熔点低,不能说明反应速率,故A错误;
B.钠浮在水面上,说明钠的密度小于水,故B正确;
C.酚酞遇碱变红色,酚酞溶液变成红色说明有氢氧化钠生成,故C正确;
D.钠球游动说明钠和水反应生成气体而使钠受力不均,故D正确;
故选A.
点评:本题考查钠的化学性质,题目难度不大,根据反应的实验现象推断可能具有的性质.
本题难度:一般
4、选择题 两种气态烃的混合气体0.1mol,完全燃烧后生成0.16molCO2和3.6g水,则混合气体是
A.一定有丙炔
B.一定是甲烷和乙烯
C.一定没有乙烷
D.一定有乙炔
参考答案:C
本题解析:分析:n(H2O)=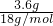 =0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,
=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,
则混合烃的平均分子式为C1.6H4,根据平均分子式进行判断.
解答:n(H2O)=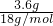 =0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,
=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,
则混合烃的平均分子式为C1.6H4,烃中C原子数小于1.6的只有甲烷,则一定含有甲烷,CH4分子中含4个氢原子,故另一种分子中一定含4个氢原子,且其碳原子数大于1.6,故可能是C2H4或C3H4,一定没有C2H6或C2H2,二者的H原子不等于4,
故选C.
点评:本题考查混合烃组成的判断,题目难度中等,本题关键是能够正确分析有机物完全燃烧生成的CO2和H2O的物质的量关系,根据平均分子式进行判断.
本题难度:一般
5、选择题 取一定质量的均匀固体混合物Cu、Cu2O和CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少,6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为
A.3.2mol.L-1
B.3.6moI.L-1
C.4.0mo1?L-1
D.无法判断
参考答案:A
本题解析:分析:将Cu2O拆分为Cu、CuO,原混合物看做Cu、CuO的混合物,其中一份用足量的氢气还原,反应后固体质量减少6.40g为拆分后Cu、CuO的混合物中O元素的质量,O原子的物质的量为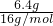 =0.4mol,根据Cu元素守恒可知n(CuO)=n(O)=0.4mol;另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,且同时收集到标准状况下NO气体4.48L,NO的物质的量为
=0.4mol,根据Cu元素守恒可知n(CuO)=n(O)=0.4mol;另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,且同时收集到标准状况下NO气体4.48L,NO的物质的量为 =0.2mol,根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=3n(NO),由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu),根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2],据此计算n(HNO3),再根据c=
=0.2mol,根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=3n(NO),由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu),根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2],据此计算n(HNO3),再根据c= 计算硝酸的浓度.
计算硝酸的浓度.
解答:将Cu2O拆分为Cu、CuO,原混合物看做Cu、CuO的混合物,其中一份用足量的氢气还原,反应后固体质量减少6.40g为拆分后Cu、CuO的混合物中O元素的质量,O原子的物质的量为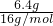 =0.4mol,根据Cu元素守恒可知n(CuO)=n(O)=0.4mol;
=0.4mol,根据Cu元素守恒可知n(CuO)=n(O)=0.4mol;
另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,且同时收集到标准状况下NO气体4.48L,NO的物质的量为 =0.2mol,根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=3n(NO)=3×0.2mol,n(Cu)=0.3mol,由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu)=0.4mol+0.3mol=0.7mol,根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2]=0.2mol+2×0.7mol=1.6mol,硝酸的浓度为
=0.2mol,根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=3n(NO)=3×0.2mol,n(Cu)=0.3mol,由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu)=0.4mol+0.3mol=0.7mol,根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2]=0.2mol+2×0.7mol=1.6mol,硝酸的浓度为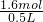 =3.2mol/L.
=3.2mol/L.
故选:A.
点评:考查混合物的计算、守恒计算等,难度中等,清楚反应过程是解题的关键,本题采取拆分法解答,简化计算过程,注意体会,可以通过列方程解答.
本题难度:简单