|
高考化学知识点归纳《物质的量》试题巩固(2017年最新版)(八)
2017-07-18 00:51:32
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某气体分子的质量为a g,则标准状况下b g该气体的体积是(式中NA为阿伏加德罗常数)( )
A.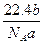 L L
B.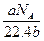 L L
C.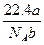 L L
D. L L
|
参考答案:A
本题解析:b g气体的物质的量为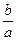 /NA,故标准状况下体积为 /NA,故标准状况下体积为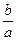 /NA×22.4 L。 /NA×22.4 L。
本题难度:一般
2、填空题 (1)8 g CH4的物质的量为 ,在标准状况下所占的体积约为 ;
(2)100mL 1 mol·L-1Al2(SO4)3溶液中含Al3+离子 mol,含SO42-离子 个。
(3)0.6mol O2与0.4mol O3质量之比为 ,分子个数之比为 ,原子个数之比 ,它们在同温同压下的体积比是 。
参考答案:(每空2分,共8分)(1)0.5mol;11.2L (2)0.2;1.806X1023个 (3)1:1;3:2;1:1;3:2
本题解析:(1)甲烷的摩尔质量是16g/mol,则根据n=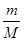 可知,8 g CH4的物质的量=8g÷16g/mol=0.5mol;标准状况下气体的摩尔体积是22.4L/mol,则根据n= 可知,8 g CH4的物质的量=8g÷16g/mol=0.5mol;标准状况下气体的摩尔体积是22.4L/mol,则根据n=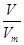 可知,在标准状况下所占的体积约为0.5mol×22.4L/mol=11.2L。 可知,在标准状况下所占的体积约为0.5mol×22.4L/mol=11.2L。
(2)100mL 1 mol·L-1Al2(SO4)3溶液中硫酸铝的物质的量=0.1L×1mol/L=0.1mol,则根据Al2(SO4)3=2Al3++3SO42-可知,溶液中含Al3+离子的物质的量=0.1mol×2=0.2mol。溶液中含SO42-离子的物质的量=0.1mol×3=0.3mol,则个数=0.3mol×6.02X1023/mol=1.806X1023个。
(3)氧气和臭氧的相对分子质量分别是32和48,则根据n=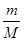 可知,0.6mol O2与0.4mol O3质量之比为0.6mol×32g/mol:0.4mol×48g/mol=1:1;根据N=nNA可知,分子个数之比为0.6mol:0.4mol=3:2;原子个数之比=0.6mol×2:0.4mol×3=1:1;根据n= 可知,0.6mol O2与0.4mol O3质量之比为0.6mol×32g/mol:0.4mol×48g/mol=1:1;根据N=nNA可知,分子个数之比为0.6mol:0.4mol=3:2;原子个数之比=0.6mol×2:0.4mol×3=1:1;根据n=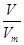 可知,它们在同温同压下的体积比=0.6mol:0.4mol=3:2。 可知,它们在同温同压下的体积比=0.6mol:0.4mol=3:2。
考点:考查物质的量、微粒数、气体体积以及物质的量浓度的有关计算
本题难度:一般
3、填空题 硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑?①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
⑴根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加___________g。
⑵配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O?g。
⑶现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况下)CO2时,吸收液质量就增加44g。
①吸收液中NaNO2和NaNO3的物质的量之比?
② 1000g 质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2?克(0℃时,NaNO2的溶解度为71.2g/100g水)?
参考答案:⑴48(2分)⑵m(Na2CO3·10H2O) = 572g(2分)
⑶①n(NaNO2)∶n(NaNO3)=5∶3(2分)
②析出:m(NaNO2)(最大) =172.5g—71.2g=101.3g?(2分)
本题解析:⑴根据反应①每产生22.4L(标准状况下)CO2,则吸收2molNO2,所以吸收液质量将增加2×46g-44g=48g。
(2)1000g 质量分数为21.2%的纯碱溶液中碳酸钠的质量是212g,物质的量是2mol,所以需要Na2CO3·10H2O的质量是2mol×286g/mol=572g。
(3)①设吸收液中NaNO2和NaNO3的物质的量分别是x和y,则反应①中吸收液增加的质量是48y。在反应②中生成的亚硝酸钠是x-y,所以吸收液增加的质量是16(x-y),则16(x-y)+48y=44,又因为y+(x-y)/2=1,解得x=5/4,y=3/4,所以吸收液中NaNO2和NaNO3的物质的量之比5︰3。
②根据①可知,反应后溶液的质量是1088g,其中亚硝酸钠是2.5mol,硝酸钠是1.5mol,所以溶液中硝酸钠是127.5g,亚硝酸钠是172.5g,所以溶剂水的质量是788g。蒸发掉688g水,剩余水是100g,因此析出亚硝酸钠是172.5g—71.2g="101.3g" 。
本题难度:一般
4、选择题 若NA表示阿伏加德罗常数的值,在4(NH4)2S 91exam .orgO4 N2+6NH3+3SO2+SO3+7H2O的反应中,当有NA个电子发生转移时,以下说法错误的是(? ) N2+6NH3+3SO2+SO3+7H2O的反应中,当有NA个电子发生转移时,以下说法错误的是(? )
A.有 NA个硫原子被还原 NA个硫原子被还原
B.有 NA个氮原子被氧化 NA个氮原子被氧化
C.有 NA个二氧化硫分子生成 NA个二氧化硫分子生成
D.有 NA个硫酸铵分解 NA个硫酸铵分解
参考答案:C
本题解析:生成3 mol SO2应有3×(6-4) mol="6" mol 电子发生转移,现有NA个电子转移,则有6∶3=NA∶x,x= Na,所以反应中有NA个电子发生转移,应有 Na,所以反应中有NA个电子发生转移,应有 NA个SO2分子生成。 NA个SO2分子生成。
本题难度:简单
5、填空题 (8分)(1) 0.5 mol SO2共约含有?个原子,它与?gSO3所含硫原子数相等。
(2)质量相同的 ①HCl、②NH3、③CO2、④O2四种气体中,含有分子数目最少的是(填序号)? _?。
(3)有100mL 0.2 mol/L 的NaOH溶液,将此溶液稀释到200 mL,则溶液中Na+的物质的量是??。
参考答案:(1)9.03×1023? 40g? (2)③? (3)0.02mol
本题解析:根据物质的量个数之比等于物质的量之比,一个SO2分子中有三个原子,所以0.5摩尔SO2中原子的物质的量是1.5摩尔,硫原子的物质的量是0.5摩尔,共含有9.03×1023个原子,0.5摩尔SO3的质量是40克,(2)质量相同,摩尔质量越大,物质的量越小,分子数目越少,CO2的摩尔质量最大,因此它的分子数目最少,(3)根据稀释前后,溶质的物质的量不变,因此Na+的物质的量是0.02mol
本题难度:一般
|