|
高考化学知识点归纳《物质的量》试题巩固(2017年最新版)(十)
2017-07-18 00:51:32
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.0.1 mol·L-1Na2S溶液中含有的Na+离子数为0.2NA
B.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
C.标准状况下,22.4 L以任意比例混合的氢气和氯气混合气中含有的原子总数为2NA
D.0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA
|
参考答案:C
本题解析:
试题解析:溶液体积未知,无法计算Na+离子数,故A错误;浓硫酸随反应进行,浓度减小为稀硫酸不与铜发生反应,生成SO2分子数目小于0.46NA,故B错误;C、标准状况下,22.4 L气体的物质的量为1mol,且氢气和氯气都是双原子分子,故原子总数为2NA,C正确;依据化学方程式定量关系计算,3Fe+4H2O=Fe3O4+4H2,0.10mol Fe粉与足量水蒸气反应生成的H2分子数为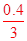 NA,故D错误。 NA,故D错误。
考点:阿伏加德罗常数
本题难度:一般
2、填空题 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。 制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。 用现代分析仪器测定TiO2粒子的大小,用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe( SO4)2标准溶液滴定Ti3+至全部生成Ti4+。 请回答下列问题:?
(1)TiCl4水解生成TiO2·xH2O的化学方程式为____。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是____。
(3)下列可用于测定TiO2粒子大小的方法是____(填字母代号)。
a.核磁共振法
b.红外光谱法
c.质谱法
d.透射电子显微镜法
(4)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是____ ;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_____(填字母代号)。
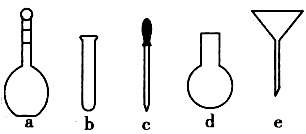
(5)滴定终点的现象是____。
(6)滴定分析时,称取TiO2(摩尔质量为Mg·mol-1)试样wg,消耗c mol·L-1 NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数表达式为____。
(7)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果___。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果____。
参考答案:(1)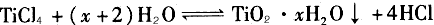
(2)取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明 CI-已除净
(3)d
(4)抑制NH4Fe(SO4)2水解;a、c
(5)溶液变为红色
(6)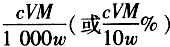
(7)①偏高②偏低
本题解析:
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数,下列说法错误的是:
A.1mol C2H6分子中共含7NA个共价键
B.25℃时,1mL纯水中含水10-10NA个OH-离子
C.当NO2溶于水产生1molNO时,反应转移的电子数为2NA。
D.标准状况下,22.4L三氧化硫所含的氧原子数等于3NA
参考答案:D
本题解析:A.1mol C2H6分子中共含7NA个共价键 ,正确;? B.25℃时,水电离出的OH-离子浓度是10-7mol/L,故1mL纯水中含水10-10NA个OH-离子,正确;C.当NO2溶于水产生1molNO时,反应转移的电子数为2NA。正确;D.标准状况下,三氧化硫是固态无法计算其物质的量,错误;
本题难度:一般
4、选择题 用98%的浓硫酸(密度为1.84g?cm-3)配制1mol?L-1的稀硫酸100mL,现给出下列仪器(配制过程中可能用到):
①100mL量筒?②10mL量筒?③50mL烧杯?④托盘天平?⑤100mL容量瓶?⑥胶头滴管?⑦玻璃棒.
按实验时使用仪器的先后顺序,排列正确的是( )
A.③②⑥⑦⑤⑥
B.②③⑦⑤⑥
C.①③⑤⑦④⑥
D.④⑦③⑤⑥?
参考答案:A
本题解析:
本题难度:一般
5、选择题 下列各溶液中,Na+?物质的量浓度最大的是 (? )
A.4L0.5mol/L NaCl溶液
B.1L0.3mol/L Na2SO4溶液
C.5L0.4mol/L NaOH
D.2L0.15mol/L Na3PO4
参考答案:B
本题解析:根据物质的化学式可知,溶液中钠离子浓度分别是(mol/L)0.5、0.6、0.4、0.45,所以正确的答案选B。
本题难度:简单
|