微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
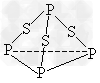
1、选择题 三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热△H?=?-3677kJ/mol(磷元素被氧化为P4O10),下列有关P4S3的说法中不正确的是?
[? ]
A.分子中每个原子最外层均达到8电子稳定结构
B.P4S3中磷元素为+3价
C.热化学方程式为P4S3(?s)+8O2(g)=P4O10(s?)+3SO2(g);△H?=-3?677kJ/mol
D.分子中存在极性键与非极性键
参考答案:B
本题解析:
本题难度:一般
2、填空题 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(将配平后的系数填在横线上)
__ C+ __ KMnO4+ ___ H2SO4→___CO2↑+ ___MnSO4 + ___K2SO4+ ___H2O
当反应中有2.408×1024个电子发生转移时,还原剂的质量为
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
实验组
| 温度℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| x
| 2.0
| 1.6
| 2.4
| 6
|
2
| 900
| 2.0
| 1.0
| 0.4
| 1.6
| 3
|
①实验1中以v(CO2)表示的反应速率为 (要求2位有效数字,下同);实验2达到平衡时CO的体积分数为 。
②若反应的平衡常数大,处理CO的效率高,则增大该反应平衡常数的措施有 。
③900℃时,该密闭容器中,加入4 molCO,3 mol H2O ,4mol CO2和2.4mol H2,比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
④一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的有 。
A.容器中气体的平均分子量不随时间而变化
B.消耗1molH2的同时消耗1molCO
C.容器中气体的密度不随时间而变化
D.CO2的体积分数不随时间而变化
(3)汽车尾气的排放对空气造成污染。目前采用的是在汽车排气装置中安装一个净化器,可以有效将尾气中的有害气体转化。如:
①CO (g)+NO2(g) =CO2(g) + NO (g) ΔH =-a kJ/mol (a>0)
② 2CO (g)+2NO(g) =2CO2(g) )+ N2 (g) ΔH =-b kJ/mol (b>0)
若用标准状况下3.36LCO还原NO2至N2(CO完全反应)时放出的热量为 kJ(用含a和b的代数式表示,下同);并写出该反应的热化学方程式 。
参考答案:(1)5、4、6、5、4、2、6 (2分); 12g (2分)
(2)① 0.13 mol·L-l· min-l(2分); 0. 53(2分)
② 降低温度(2分) ③ <(2分) ④B D(2分)
(3) 3(2a+b)/80(2分) ;
4CO (g)+2NO2(g) =4CO2(g) )+ N2 (g) ΔH=-(2a+b) kJ/mol (2分)
本题解析:(1)根据化合价升降法配平该反应,高锰酸钾中锰元素化合价降低5价,碳元素化合价升高4价,化合价升高数等于化合价降低数,所以高锰酸钾前的系数是4,碳单质前的系数是5,根据原子守恒,配平其他物质的系数,配平如下:5 C+ 4 KMnO4+ 6 H2SO4
本题难度:困难
3、简答题 近年来我国的航天事业取得了巨大的成就,在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂.
(1)液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1g肼充分反应后生成气态水放出热量为aKJ,试写出该反应的热化学方程式______.
(2)在实验室中,用N2H4?H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼.
①在蒸馏过程中不需要的仪器是______(填序号字母).
A.酒精灯 B.长直玻璃导管 C.锥形瓶D.冷凝管
E.牛角管(接液管) F.蒸馏烧瓶 G.酸式滴定管
②除上述必需的仪器外,还缺少的玻璃仪器是______.
(3)肼能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可减缓锅炉锈蚀.若反应过程中肼转化为氮气,则每生成1mol Fe3O4,需要消耗肼的质量为______g.
(4)磁性氧化铁(Fe3O4)的组成可写成FeO?Fe2O3.某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质).探究过程如下:
提出假设:假设1.黑色粉末是CuO;假设2.黑色粉末是Fe3O4;
假设3.______.
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂.
①若假设1成立,则实验现象是______.
②若所得溶液显血红色,则假设______成立.
③为进一步探究,继续向所得溶液加入足量铁粉,若产生______的现象,则假设3成立.
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显.
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3?H2O═Cu(NH3)42++4H2O.
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生______现象;若产生______现象,则假设3成立.
参考答案:(1)N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) Q
1gaKJ
64g 64aKJ
所以该反应的热化学方程式为:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)△H1=-64a kJ?mol-1,
故答案为:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)△H1=-64a kJ?mol-1;
(2)蒸馏实验用到的仪器有:酒精灯,蒸馏烧瓶,温度计,冷凝器,长导管,牛角管,烧杯.
在蒸馏过程中不需要的仪器是长直玻璃导管、酸式滴定管;
除上述必需的仪器外,还缺少的玻璃仪器是温度计;
故答案为:①BG; ②温度计;
(3)因Fe3O4可以写成FeO?Fe2O3,可知1个Fe3O4中有2个铁为+3价,1个铁为+2价,所以由Fe2O3形成一个Fe3O4得到1个电子,则每生成1mol Fe3O4,转移电子的物质的量为1mol;
因由Fe2O3形成一个Fe3O4得到1个电子,1个N2H4(肼)转变成N2得到4个电子,根据电子得失守恒:n(Fe3O4)×1=n(N2H4)×4,所以n(N2H4)=0.25mol,则m(N2H4)=0.25mol×32g/mol=8g,
故答案为:8;
(4)该物质是黑色固体,也可能既含有CuO又含有Fe3O4黑色粉末,是CuO和Fe3O4的混合物;
故答案为:黑色粉末是CuO和Fe3O4的混合物;
①硫酸与氧化铜发生反应:CuO+H2SO4=CuSO4+H2O,硫酸铜溶液显蓝色,若假设1成立,实验现象为:溶液显蓝色,
故答案为:溶液显蓝色;
②三价铁离子与KSCN试剂络合成红色络合物,所以如果所得溶液显血红色,证明加入硫酸后生成了三价铁离子,说明黑色物质中含有Fe3O4,所以假设2或3都有可能,
故答案为:2或3;
③铁粉与铜离子发生反应:2Cu2++Fe=3Fe2++Cu,所以如果产生红色物质,证明溶液中存在铜离子,则黑色固体中含有CuO
,故假设3正确;
故答案为:有红色固体析出;
④如果假设2成立,则加入硫酸后得到的溶液中含有三价铁离子,加入氨水后生成氢氧化铁红褐色沉淀;如果假设3成立则加入硫酸后溶液中既含有三价铁离子还含有铜离子,加入足量氨水反应生成氢氧化铁红褐色沉淀;铜离子与氨水发生反应Cu2++4NH3?H2O═Cu(NH3)42++4H2O,盐酸变为深蓝色,
故答案为:红褐色沉淀;红褐色沉淀,同时溶液呈深蓝色.
本题解析:
本题难度:一般
4、选择题 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)=2HCl(g)+Q1,H2(g)+Br2(g)=2HBr(g)+Q2 有关上述反应的叙述正确的是
[? ]
A.Q1>Q2
B.生成物总能量均高于反应物总能量
C.生成1molHCl气体时放出Q1热量
D.1mol HBr(g)具有的能量大于1mol HBr(1)具有的能量
参考答案:AD
本题解析:
本题难度:一般
5、简答题 通常人们把拆开1mol?某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
| 化学键 | Cl-Cl | H-H | H-Cl | N≡N
键能/kJ?mol
243
436
431
946
|
(1)按要求完成填空
a?2HCl(g)=H2(g)+Cl2(g);△H=______
b?N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,则N-H键的键能是______kJ?mol
(2)1mol?NO2和1mol?CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______
______
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO?(g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=______(用含△H1、△H2、△H3的式子表示)
(4)已知:2Al?(s)+O2(g)═Al2O3(s)△H=-1?644.3kJ?mol-1
2Fe?(s)+O2(g)═Fe2O3(s)△H=-815.88kJ?mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式______.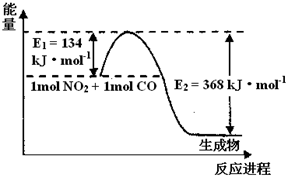
参考答案:(1)a?2HCl(g)=H2(g)+Cl2(g);△H=(2×431)kJ?mol-1-(436kJ?mol-1+243 kJ?mol-1)
═+183?kJ/mol?
b? N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,
△H=946 kJ/mol+(3×431)kJ/mol-3×2×N-H键的键能=-92kJ/mol,
所以N-H键的键能=391 kJ/mol?
故答案为:+183?kJ/mol;? 391
(2)因反应物的物质的量都为1mol,所以其反应物的计量数为1,再根据原子守恒配平方程式;
根据图象知,△H=-(E2-E1)=-(368-134)kJ/mol=-234 kJ?mol-1
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ?mol-1
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
?②2CO?(g)+O2(g)=2CO2(g)△H2
? ③H2O(g)=H2O(l)△H3
? 则CH3OH(l)+O2(g)=CO(g)+2H2O由 12①-12②+2③得到,
所以△H=12△H1-12△H2+2△H3
故答案为:12△H1-12△H2+2△H3
(4)铝热反应的反应物是铝粉与氧化铁粉末,生成物是铁和氧化铝,
2Al?(s)+32O2(g)═Al2O3(s)△H=-1?644.3kJ?mol-1 ①
2Fe?(s)+32O2(g)═Fe2O3(s)△H=-815.88kJ?mol-1 ②
方程式①-②得2Al?(s)+Fe2O3(s)?△?.?Al2O3(s)+2Fe?(s)
所以△H=△H(①)-△H(②)=-1?644.3kJ?mol-1-(-815.88kJ?mol-1)
=-828.42?kJ?mol-1
故答案为:2Al?(s)+Fe2O3(s)═Al2O3(s)+2Fe?(s)△H=-828.42?kJ?mol-1
本题解析:
本题难度:一般