微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)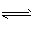 NH3 (g) + HI( g) ; ②2HI(g)
NH3 (g) + HI( g) ; ②2HI(g)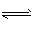 H2(g) +I2(g)达到平衡时,c(H2) =0.5mol·L-1, c( HI)=4mol·L-1,则此温度下反应①的平衡常数为
H2(g) +I2(g)达到平衡时,c(H2) =0.5mol·L-1, c( HI)=4mol·L-1,则此温度下反应①的平衡常数为
[? ]
A.9mol2·L-2
B.16mol2·L-2
C.20mol2·L-2
D.25mol2·L-2
2、简答题 在一定温度下的2L密闭容器中充入0.4molSO2和0.2molO2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,n(O2)随时间的变化如图实线所示:
(1)用SO2表示0~4min内该反应的平均速率为______.该温度下反应的平衡常数K为______.升高温度K值______(填“增大”、“不变”或“减小”).
(2)若温度不变,在容器中再加1molO2,重新达到平衡,则SO2的平衡浓度______(填“增大”、“不变”或“减小”),氧气的转化率______(填“升高”、“不变”或“降低”),SO3的体积分数______(填“增大”、“不变”或“减小”).
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是______,曲线II对应的实验条件改变是______.

3、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表
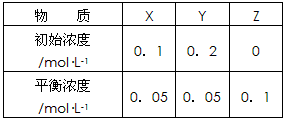
下列说法错误的是
[? ]
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变压强可以改变此反应的平衡常数
4、填空题 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。 (1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g) +2H2O(g) △H = -574 kJ/mol
CH4(g) +4NO(g) = 2N2(g) +CO2(g) +2H2O(g) △H = -1160 kJ/mol
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 _______________。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g) +6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
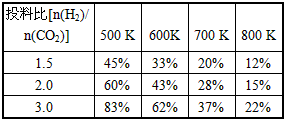
①若温度升高,则反应的平衡常数K将_________(填“增 大”“减小”或“不变”,下同);若温度不变,提高投料比[n(H2) /n(CO2)],则K将__________。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式__________________。
③在②所确定的电池中,若通入甲醚(沸点为-24.9℃)的速率为1.12 L/min(标准状况),并以该电池作为电源电解2 mol/L CuSO4溶液500 mL,则通电30s后理论上在阴极可析出金属铜____g。
5、选择题 下列各表述与示意图一致的是
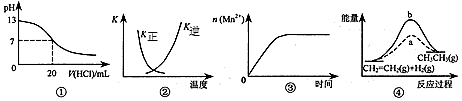
[? ]
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 B.图②中曲线表示反应2SO2(g) + O2(g) 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2(g) + H2(g)→CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化