微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 VL Fe2(SO4)3溶液中,含有Fe3+ mg,则溶液中SO42-的物质的量浓度为
[? ]
A.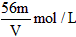
B.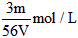
C.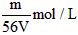
D.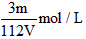
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列有关叙述正确的是( )
A.用一充满氨气的烧瓶做喷泉实验,所得氨水的物质的量浓度是(按标准状况下计算)0、045mol?L-1
B.由于浓硫酸有强氧化性因此在常温下可迅速与铜片反应放出二氧化硫气体
C.将浓硫酸滴在纸上由于浓硫酸的强氧化性,而使纸变黑
D.硫在纯氧中燃烧的产物是三氧化硫
参考答案:A、设容器容积为VL,标准状况下VL氨气的物质的量为:VL22.4L/mol=V22.4mol,氨气极易溶于水,反应达到了V22.4mol溶质一水合氨,溶于体积为VL,则氨水的物质的量浓度为:V22.4molVL≈0.045mol/L,故A正确;
B、尽管浓硫酸有强氧化性,但必须在加热条件下浓硫酸才能与铜片发生反应,故B错误;
C、浓硫酸具有脱水性,将浓硫酸滴在纸上,纸片被浓硫酸脱水,而使纸变黑,故C错误;
D、硫在纯氧中燃烧生成产物是二氧化硫,故D错误;
故选A.
本题解析:
本题难度:简单
3、选择题 将50毫升0.5mol/L的NaOH溶液加水稀释到250毫升,稀释后的NaOH溶液的浓度是( )
A.0.1mol/L
B.0.3mol/L
C.0.5mol/L
D.0.2mol/L
参考答案:令稀释后的氢氧化钠溶液的浓度为c,根据稀释定律,稀释前后溶质的物质的量不发生不变,则:
50ml×0.5mol/L=250ml×c
解得c=0.1mol/L.
故选:A
本题解析:
本题难度:简单
4、简答题 在足量浓硝酸中加入3.84g?Cu片,反应完全后,使产生的气体(只含有一种气体)通入800mL?H2O中充分反应,设反应后溶液体积不变.
(1)写出产生的气体通入水中的化学反应方程式,并指出氧化剂与还原剂质量之比;
(2)试求将气体通入水中充分反应后得到的溶液的物质的量浓度.
参考答案:(1)NO2与水反应方程式3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,由产物中氮元素的化合价,可知起氧化剂与还原剂的NO2物质的量之比为1:2.所以起氧化剂和还原剂的NO2的质量比为1:2.
答:反应方程式3NO2+H2O═2HNO3+NO,起氧化剂和还原剂的NO2的质量比为1:2.
(2)令3.84g?Cu与浓硝酸反应生成的二氧化氮的物质的量为xmol,则:
Cu+4HNO3═2NO2↑+Cu(NO3)2+2H2O
64g? 2mol
3.84g? xmol
所以3.84g64g=xmol2mol,解得x=0.12.
令0.12mol二氧化氮与水反应生成硝酸ymol,则:
3NO2+H2O═2HNO3+NO
3? 2
0.12mol? ymol
所以y=0.08mol
所以形成的硝酸溶液的浓度为0.08mol0.8L=0.1mol/L.
答:形成的硝酸溶液的浓度为0.1mol/L.
本题解析:
本题难度:一般
5、填空题 回答下列问题(填序号):
(1)下列仪器中:①漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥量筒;⑦燃烧匙.常用于物质分离的是______,其中根据物质沸点不同来分离物质的仪器是______.(用序号填写)
(2)今欲用NaOH固体配制500mL0.2mol/L的NaOH溶液.根据题意填空:
A.配制该溶液应选用______mL容量瓶.
B.用托盘天平称取______g固体NaOH.
C.将称好的NaOH固体放至500mL的大烧杯中,倒入约250mL蒸馏水,用______搅拌至完全溶解.待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶.
D.用少量蒸馏水洗涤烧杯2-3次,并将每次洗涤的溶液都注入容量瓶,轻轻晃动容量瓶,使溶液混和均匀.
E.向容量瓶中加入蒸馏水,直到液面离刻度线约1-2厘米时,改用______滴加蒸馏水至液面与刻度线相切.盖好瓶塞,摇匀.如果加水时液面超过刻度线,将使配得的溶液浓度______(填“偏高”、“偏低”或“无影响”).
F.配制好的溶液______(填“能”或“不能”)长期存放在容量瓶中.
参考答案:(1)漏斗用于固液分离、蒸馏烧瓶分离沸点相差互不相溶的液体、分液漏斗分离互不需要的液体;容量瓶用于溶液配制与可以用于固定体积量取,天平称量固体,量筒量取液体,
故答案为:①③⑤;③;
(2)A.配制500mL0.2mol/L的NaOH溶液,所以选择500mL容量瓶,故答案为:500;
B.配制500mL0.2mol/L的NaOH溶液需要氢氧化钠的质量0.5L×0.2mol/L×40g/mol=4.0g,故答案为:4.0;
C.固体溶解需要用玻璃棒搅拌,加速溶解,故答案为:玻璃棒;
E.向容量瓶中加入蒸馏水,直到液面离刻度线约1-2厘米时,改用胶头滴管滴加蒸馏水至液面与刻度线相切;
加水时液面超过刻度线,所配溶液体积降低,将使配得的溶液浓度偏低,故答案为:胶头滴管;偏低;
F.一些强碱溶液会腐蚀玻璃,存放时间久了会影响容量瓶的容量,配制好的溶液不能长期存放在容量瓶中,故答案为:不能.
本题解析:
本题难度:简单