微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下面不是污水处理方法的是
A.氧化还原法
B.中和法
C.过滤法
D.沉淀法
参考答案:C
本题解析:分析:常用的污水处理法有:中和法、沉淀法、混凝、氧化还原法等方法.
解答:现代废水处理方法主要分为物理处理法、化学处理法和生物处理法三类,
化学处理法有:中和法、化学混凝法、氧化还原法等;
物理处理法有:通常采用沉淀、过滤、离心分离、气浮、蒸发结晶、反渗透等方法;
生物处理法又分为需氧处理和厌氧处理两种方法.
而过滤不能除去污水中的有害物质,只能将不溶于水的固体物质除去,故过滤法不是污水处理方法.
故选C.
点评:本题考查常见污水的处理方法,题目难度不大,有些做法和我们实验室物质的分离提纯方法相似,注意基础知识的积累.
本题难度:简单
2、选择题 由Zn、Fe、Al、Mg四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标况下为11.2升,则混合物中一定含有的金属是
A.Zn
B.Al
C.Fe
D.Mg
参考答案:B
本题解析:分析:计算出氢气的质量,根据氢气的质量计算出各自反应时所需金属的质量,两种金属组成的混合物产生氢气11.2升时所需质量10g,应介于两金属分别于盐酸反应生成11.2升氢气时消耗金属量的之间.
解答:在标况下氢气的物质的量为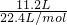 =0.5mol,
=0.5mol,
?Zn~H2
65g? 1mol?
32.5g? 0.5mol
所以生成氢气11.2升,需要Zn的质量为32.5g.
2Al~3H2
54g? 3mol?
9g?0.5mol
所以生成氢气11.2升,需要Al的质量为9g.
Fe~H2
56g? 1mol?
28g? 0.5mol
所以生成氢气11.2升,需要Fe的质量为28g.
Mg~H2
24g? 1mol?
12g? 0.5mol
所以生成氢气11.2升,需要Mg的质量为12.
两种金属组成的混合物产生氢气11.2升时所需质量10g,应介于两金属分别于盐酸反应生成11.2升氢气时消耗金属量的之间.只有Al的质量小于10g,所以混合物中一定含有Al.
故选B.
点评:本题考查混合物的有关计算,难度中等,本题采取极值法解答,从而简化计算.注意若有不反应的金属应视作需金属质量无穷大.
本题难度:一般
3、选择题 下列有关实验原理或操作叙述正确的是
A.过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解,是因为铜可直接与1mol/L稀硫酸反应
B.用CCl4萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
C.向某溶液中加入新制Cu(OH)2,加热后出现红色沉淀,说明该溶液中一定含醛类物质
D.测氯水的pH值,可用干燥洁净的玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
参考答案:B
本题解析:分析:A.NO3-在酸性条件下具有强氧化性,可与铜反应;
B.CCl4密度比水大;
C.向某溶液中加入新制Cu(OH)2,加热后出现红色沉淀,说明有机物中含有-CHO;
D.氯水可使pH试纸先变红后褪色.
解答:A.过量的铜屑与稀硝酸作用,反应停止后,溶液中存在NO3-,再加入1mol/L稀硫酸,是由于NO3-在酸性条件下具有强氧化性,可与铜反应,而铜和稀硫酸不反应,故A错误;
B.CCl4密度比水大,分液时,在分液漏斗的下层,有机层从分液漏斗的下端放出,故B正确;
C.向某溶液中加入新制Cu(OH)2,加热后出现红色沉淀,说明有机物中含有-CHO,但不一定为醛类物质,可能为还原性糖、甲酸或甲酸酯等物质,故C错误;
D.氯水可使pH试纸先变红后褪色,充分反应后为白色,无法测pH,故D错误.
故选B.
点评:本题考查较为综合,涉及硝酸的性质、有机物的分离、检验以及氯水的性质,题目难度不大,注意相关物质的性质,学习中注意积累.
本题难度:困难
4、选择题 将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),向反应后的溶液中加入150mL一定浓度的NaOH溶液恰好沉淀完全,测得生成沉淀的质量比原合金的质量增加7.65g,则下列叙述中不正确的是
A.所用的NaOH溶液的物质的量浓度为3mol?L-1
B.当金属全部溶解时,收集到NO气体的体积一定为3.36L
C.参加反应的金属的总质量(m)为5.4g<m<14.4g
D.若将产生的气体全部转化为硝酸,则至少需要标况下2.52L的氧气
参考答案:AB
本题解析:分析:本题涉及到的反应有:3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O;3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O;
Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3;Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3.
将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),向反应后的溶液中加入15mL一定浓度的NaOH溶液恰好沉淀完全,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加7.65g,则氢氧化镁和氢氧化铜含有氢氧根的质量为7.65g,氢氧根的物质的量为 =0.45mol,则镁和铜的总的物质的量为0.225mol,根据电子转移守恒可知生成的NO物质的量为
=0.45mol,则镁和铜的总的物质的量为0.225mol,根据电子转移守恒可知生成的NO物质的量为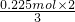 =0.15mol.
=0.15mol.
A、加入的氢氧化钠可能中和为反应的硝酸;
B、根据电子转移守恒计算NO物质的量,结合气体不一定是标准状况判断;
C、镁和铜的总的物质的量为0.225mol,利用极限法假定全为镁、全为铜计算判断;
D、根据4NO+3O2+2H2O=4HNO3计算判断.
解答:本题涉及到的反应有:3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O;3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O;
Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3;Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3.
将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),向反应后的溶液中加入15mL一定浓度的NaOH溶液恰好沉淀完全,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加7.65g,则氢氧化镁和氢氧化铜含有氢氧根的质量为7.65g,氢氧根的物质的量为 =0.45mol,则镁和铜的总的物质的量为0.225mol,根据电子转移守恒可知生成的NO物质的量为
=0.45mol,则镁和铜的总的物质的量为0.225mol,根据电子转移守恒可知生成的NO物质的量为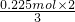 =0.15mol.
=0.15mol.
A、若硝酸无剩余,则氢氧化钠的物质的量等于0.45mol,氢氧化钠溶液的浓度为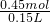 =3mol/L,硝酸可能有剩余,如剩余则氢氧化钠溶液的浓度大于3mol/L,故A错误;
=3mol/L,硝酸可能有剩余,如剩余则氢氧化钠溶液的浓度大于3mol/L,故A错误;
B、镁和铜的总的物质的量为0.225mol,根据电子转移守恒可知生成的NO物质的量为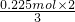 =0.15mol,若为标准状况下,生成NO的体积为0.15mol×22.4L/mol=3.36L,但NO不一定处于标准状况,故B错误;
=0.15mol,若为标准状况下,生成NO的体积为0.15mol×22.4L/mol=3.36L,但NO不一定处于标准状况,故B错误;
C、镁和铜的总的物质的量为0.225mol,假定全为镁,质量为0.225mol×24g/mol=5.4g,若全为铜,质量为0.225mol×64g/mol=14.4g,所以参加反应的金属的总质量(m)为5.4g<m<14.4g,故C正确;
D、根据电子转移守恒可知生成的NO物质的量为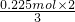 =0.15mol,由4NO+3O2+2H2O=4HNO3可知,至少需要氧气的物质的量为0.15mol×
=0.15mol,由4NO+3O2+2H2O=4HNO3可知,至少需要氧气的物质的量为0.15mol×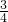 ,需标准状况下氧气体积为0.15mol×
,需标准状况下氧气体积为0.15mol×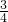 ×22.4L/mol=2.52L,故D正确.
×22.4L/mol=2.52L,故D正确.
故选AB.
点评:本题结合镁铜与硝酸反应、生成的盐与氢氧化钠反应,综合考查学生的得失电子守恒、质量守恒的综合计算能力,同时也考查了学生的学习综合运用和解决复杂问题的能力,是一道考查能力的好题,难度较大.
本题难度:困难
5、选择题 下列物质中不能通过置换反应生成的是
A.F2
B.CO
C.Fe3O4
D.S
参考答案:A
本题解析:分析:A、因F的非金属性最强,则不能发生置换反应来制取单质;
B、根据碳与二氧化硅的反应来分析;
C、根据铁和水蒸气的反应来分析;
D、根据氯气和硫化氢的反应来分析.
解答:A、因F的非金属性最强,则单质的氧化性最强,没有比F2单质氧化性强的物质通过置换反应来氧化F-生成F2,故A不能;
B、由2C+SiO2 2CO+Si,则可以利用置换反应生成CO,故B能;
2CO+Si,则可以利用置换反应生成CO,故B能;
C、由3Fe+4H20 Fe3O4+4H2↑,则可以利用置换反应生成Fe3O4,故C能;
Fe3O4+4H2↑,则可以利用置换反应生成Fe3O4,故C能;
D、由Cl2+H2S═S↓+2HCl,则可以利用置换反应生成S,故D能;
故选A.
点评:本题考查常见的氧化还原反应及置换反应,明确置换反应一定是氧化还原反应,学生熟悉常见物质的性质及物质转化中的化学反应是解答的关键.
本题难度:简单