微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 以惰性电极电解NaCl溶液或CuSO4溶液都得到三种产物A、B、C,各物质之间的转化关系如下图所示(图 中参与反应和生成的水都已略去)。已知甲是短周期元素的单质,它是日常生活中常用的包装材料。

回答下列问题:
(1)若电解的是NaCl溶液:
①甲与A反应的化学方程式是_______________。
②A与B反应的离子方程式是________________。
③常温下,若电解100mL 0.1 mol/L NaCl溶液,阴、阳两极各产生112mL气体(标准状况),则所得溶液的pH为______________(忽略反应前后溶液的体积变化及气体溶于水的影响)。
(2)若电解的是CuSO4溶液,加热时,A的浓溶液可与B发生反应:
①A的浓溶液与B反应过程中,A的浓度随时间变化的图像正确是__________ 。

②E的化学式是____________ ;电解时阳极的电极反应式是_____________。
2、选择题 对于冶炼像钠、钙、镁、铝这样活泼的金属,电解法几乎是唯一可行的工业方法。下列有关说法中正确的是
[? ]
A.电解熔融NaOH可生成金属钠、O2以及H2
B.电解熔融CaCl2时,金属钙在阳极生成
C.可用电解饱和MgCl2溶液的方法获得金属镁
D.电解熔融Al2O3制备金属铝时,要加入冰晶石,使Al2O3在较低温度下熔解
3、填空题 工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。

(1)上图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是___________ NaOH溶液的出口为_________(填字母);精制饱和食盐水的进口为_______________ (填字母);干燥塔中应使用的液体是__________。
(2)多晶硅主要采用SiHCl3,还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为__________________________
②SiCl4可转化为SiHCl3,而循环使用。一定条件下,在20 L恒容密闭容器中的反应:
 达平衡后,H2和SiHCl3物质的量浓度分别为0.140mol/L和0.020 mo1/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为_______ kg。
达平衡后,H2和SiHCl3物质的量浓度分别为0.140mol/L和0.020 mo1/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为_______ kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0 kg,则生成氢气___________m3(标准状况)。
4、简答题 (一)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO?(Al2O3)______(2)Cl2(HCl)______
(3)FeCl3(FeCl2)______(4)NaHCO3溶液(Na2CO3)______
(二)海水中含有大量的氯化镁,从海水中提取镁的生产流程如图1所示:
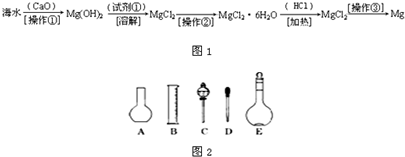
回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式______;
操作①主要是指______;试剂①可选用______;操作②是指______;经操作③最终可得金属镁.
(三)实验室配制480ml?0.1mol?L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体______g.
(2)如图2所示的仪器配制溶液肯定不需要的是______(填序号),本实验所需玻璃仪器E规格为______mL.
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的______.(填数字符号)
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是______.(填写字母,每种仪器只能选择一次)
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了______种用途.(填写数字)
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是______.
A.配制前设有将容量瓶中的水除尽;?B.碳酸钠失去了部分结晶水;
C.碳酸钠晶体不纯,其中混有氯化钠;?D.称量碳酸钠晶体时所用砝码生锈;? E.定容时仰视刻度线.
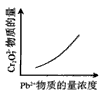
5、选择题 电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCr4):Cr2O72-(aq)+2Pb2+(aq)+H2O(l)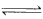 2PbCrO4(s)+2H+(aq) ΔH< 0 该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是
2PbCrO4(s)+2H+(aq) ΔH< 0 该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是
[? ]
A.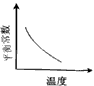
B.
C.
D.