微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液 pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成 ClO-,把二价镍氧化为三价镍。以下说法正确的是
[? ]
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应是2Cl--2e-=Cl2↑
D.1mol+2价镍全部变为+3价时,外电路通过1mol电子
参考答案:CD
本题解析:
本题难度:一般
2、选择题 下列实验目的可以达到的是( )
A.电解熔融氯化镁制取金属镁
B.醋酸钠结晶水合物与碱石灰共热制取甲烷
C.浓硫酸与溴化钠共热制取溴化氢
D.饱和碳酸钠溶液除去二氧化碳中的氯化氢
参考答案:A
本题解析:
本题难度:简单
3、简答题 某化学小组采用下图装置模拟电解饱和食盐水制备氢气,通过氢气还原氧化铜测定Cu的相对原子质量,同时检验氯气的氧化性(图中夹持和加热仪器已经略去).

(1)写出装置甲中反应的离子方程式______.为完成上述实验,正确的连按方式为a连接______,b连接______(填字母).
(2)①装置乙烧杯中液体的作用是______.A瓶内盛装的溶液最好是______(填字母).
a.I2-淀粉溶液b.NaOH溶液 c.FeCl2与KSCN混合溶液d.Na2SO3溶液
②加热装置丙中的氧化铜粉末之前,除了要检查该装置的气密性还需进行的必要操作是______.
(3)利用装置丙测定Cu的相对原子质量,现有两种方案:①测得反应前后洗气瓶B及其中液体质量差m1,②测得反应前后U形管及其中固体质量差m2.你认为合理的方案为______(填“①”或“②”).若采用测得反应后硬质玻璃管中剩余固体的质量m3的方案,已知O的相对原子质量为16,实验中氧化铜样品质量为m,则测定Cu的相对原子质量的表达式为______,该方案在反应后硬质玻璃管冷却过程中没有一直通氢气,会导致测定Cu韵相对原子质量______(填“偏大”、“偏小”或“无影响”),理由是______.
参考答案:(1)电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,溶液中同时生成氢氧根离子,所以电解反应离子方程式为2Cl-+2H2O电解.2OH-+H2↑+Cl2↑,要检验氯气的氧化性,则氯气连接强还原性的物质且反应现象要明显,故选c,用氢气还原氧化铜来检验氢气,因为电解得到的氢气中含有水蒸气,所以在实验前要除去水蒸气,故选e,
故答案为:2Cl-+2H2O电解.2OH-+H2↑+Cl2↑;e;c;
(2)①氯气有毒,不能直接排空,氯气和水反应生成酸,所以氯气可以用碱性物质来处理,所以装置乙烧杯中液体的作用是吸收多余的氯气,防止环境污染;
氯气具有强氧化性,能氧化强还原性的物质,要检验氯气,必须选用强还原性的物质且反应现象明显,
a.氯气能氧化碘而使溶液褪色,氯气和水反应生成的次氯酸也能使溶液褪色,所以无法证明氯气的氧化性,故不选;
b.氯气和氢氧化钠溶液反应生成氯化钠和次氯酸钠,反应现象不明显,故不选;
c.氯气能把亚铁离子氧化成三价铁离子,铁离子和硫氰化钾溶液反应生成血红色溶液,反应现象明显,且能检验氯气的氧化性,故选;
d.氯气能氧化亚硫酸钠生成硫酸钠,但反应前后溶液颜色不变,反应现象不明显,故不选;
故答案为:吸收多余的氯气,防止环境污染;c;
②氢气是可燃性气体,与氧气混合,加热容易发生爆炸危险,加热氧化铜之前要通入氢气排尽装置内空气,故答案为:通入氢气排尽装置内空气;
(3)①中质量的差量是氢气还原氧化铜得到的物质,与铜有关,所以能计算铜的相对原子质量,②中质量的差量是氢气中原来的水蒸气,与铜无关,所以不能计算铜的相对原子质量,故选①;
硬质玻璃管中的质量差是氧元素的质量=m-m3,
设铜的相对原子质量为x,
CuO------O
1 16
mx+16 m-m3
x=16m3m-m3,
反应生成的铜被空气的氧气氧化使m3数据增大,则16m3m-m3偏大,所以导致测定结果偏大,
故答案为:①;16m3m-m3;偏大;反应生成的铜被空气的氧气氧化使m3数据增大,导致测定结果偏大.
本题解析:
本题难度:简单
4、选择题 对于铁、铜、金的冶炼,下列说法错误的是( )
A.工业上用铝单质与Fe2O3反应来大规模制备生铁
B.可用焦碳与氧化铜高温反应制备铜
C.古代“沙里淘金”是将金单质富积
D.工业上由生铁炼钢以及由粗铜(含杂质较多的铜)制备纯铜都是进一步除去里面杂质
参考答案:A
本题解析:
本题难度:一般
5、填空题 六价铬对人体有毒,含铬废水要经过化学处理后才能排放。工业上为处理含有Cr2O72-的酸性废水采用如下方法:在工业废水中加入适量NaCl,然后以铁为电极电解,鼓入空气,最后将Cr2O72-以Cr(OH)3形式沉淀下来而除去,且还生成Fe(OH)3沉淀,这种处理方法可使工业废水中的Cr2O72-含量达到国家规定的排放标准。
试回答:
(1)在工业废水中加入NaCl的作用是____。
(2)有关的电极反应式是____。
(3)由Cr2O72-转化为Cr3+的离子方程式是___。
(4)电解过程中工业废水由酸性变碱性的原因是___。
(5)另一种处理含铬废水的方法是用绿矾 [FeSO4·7H2O]把废水中的六价铬还原成铬离子,再加入过量石灰水,使铬离子转为氢氧化铬[Cr(OH)3]沉淀,其主要反应的化学方程式如下:
H2Cr2O7+6FeSO4+6H2SO4=3Fe2(SO4)3+ Cr2 (SO4)3+7H2O
现用上法处理1×104 L含铬(+6价)78 mg·L-1 的废水(Cr的相对原子质量为52),
试回答:
①处理后沉淀除Cr(OH)3外,还有__ (用化学式来表示)。
②需用绿矾多少千克?____。
参考答案:(1)②2H2O 2H2+O2
2H2+O2
③2N2+6H2O 4NH3 +3O2
4NH3 +3O2
④2CO2+4H2O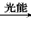 2CH3OH+3O2
2CH3OH+3O2
⑤CO2+2H2O CH4 +2O2
CH4 +2O2
(2)如何使物质吸收光能转变为其他物质
(3)绿色植物的光合作用,即在日常作用下,利用光能把二氧化碳和水转变成碳水化合物(糖类)
6CO2+6H2O C6H12O6 +6O2
C6H12O6 +6O2
本题解析:
本题难度:一般