微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)一包粉末可能含有K+、Fe3+、Al3+、Cl-、SO42-、CO32-中的若干种,现进行以下实验:
(1)取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
(2)向(1)所得溶液中加入一定量Ba(OH)2溶液,生成有色沉淀,过滤后在滤液中加入稀硝酸酸化,然后滴入AgNO3溶液,有白色沉淀生成;
(3)取(2)中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
(4)重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
(5)向(4)所得的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤。往得到的沉淀中加入过量的NaOH溶液,沉淀减少。
根据上述实验,这包粉末中一定不含有的离子是?,肯定含有的离子是?,不能确定是否含有的离子是?,可通过?(填实验方法)来进一步确定该离子。
参考答案: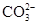 、
、 ;?
;?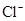 、Al3+、
、Al3+、 ;?
;?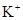 ;?焰色反应
;?焰色反应
本题解析:根据(1)可知气体放出,说明没有CO32-。由(2)可知有色沉淀应该是氢氧化铁沉淀,即一定含有铁离子。滤液中加入硝酸酸化的硝酸银生成沉淀,说明一定含有氯离子。根据(3)可知沉淀中没有硫酸钡,说明一定没有SO42-。根据(5)可判断,沉淀中含有氢氧化铝,说明一定还含有铝离子。根据以上分析可知钾离子是无法确定的,需要透过焰色反应进一步确定。
本题难度:一般
2、选择题 设NA表示阿伏加德罗常数的值,下列说法正确的是
A.7.8?g?Na2O2中含有的离子总数为0.3?NA
B.1?mol?FeCl3制成胶体,所得胶体粒子数目为NA
C.pH=13的氢氧化钠溶液中所含Na+为0.1NA
D.5.6?g铁与足量的盐酸反应失去电子数为0.2?NA
参考答案:AD
本题解析:分析:A、依据n=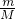 计算物质的量结合过氧化钠结构计算离子数;
计算物质的量结合过氧化钠结构计算离子数;
B、胶体粒子是氢氧化铁的集合体;
C、溶液体积不知不能计算微粒数;
D、依据n=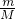 计算物质的量,结合铁 盐酸反应生成氯化亚铁.
计算物质的量,结合铁 盐酸反应生成氯化亚铁.
解答:A、7.8?g?Na2O2中物质的量为0.1mol,过氧化钠是钠离子和过氧根离子构成,所以含有的离子总数为0.3NA,故A正确;
B、1?mol?FeCl3制成胶体,胶体粒子是氢氧化铁的集合体,所得胶体粒子数目小于NA,故B错误;
C、pH=13的氢氧化钠溶液中,溶液体积不知,所含Na+数不能计算,故C错误;
D、5.6?g铁物质的量为0.1mol,与足量的盐酸反应失去电子数为0.2?NA,故D正确;
故选AD.
点评:本题考查阿伏伽德罗常的应用,主要考查质量换算物质的量计算微粒数,注意胶体离子的组成判断,题目较简单.
本题难度:困难
3、实验题 某校化学小组的同学进行以碳棒为电极电解氯化铜溶液时发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,设计了如下过程:
Ⅰ、有关资料
铜的化合物颜色性质如下:
物质
| 颜色、性质
| 物质
| 颜色、性质
|
氢氧化铜Cu(OH)2
| 蓝色固体不溶于水
| 硫酸铜(CuSO4)
| 溶液呈蓝色
|
氧化亚铜(CuO)
| 红色固体不溶于水
| 氯化铜(CuCl2)
| 溶液呈绿色,稀溶液呈蓝色
|
氯化亚铜(CuCl)
| 白色固体不溶于水
| 碱式氯化铜
| 绿色固体不溶于水
|
Ⅱ、探究实验
(1)提出假设:①红色物质一定有铜,还可能有Cu2O;②白色物质为铜的化合物,其化学式可能为CuCl
(2)实验验证:取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色。
①碳棒上的红色物质是否有Cu2O?(填“是”或“否”),理由是?
?;②在c装置后将气体通入?中,若出现白色沉淀,可说明提出假设②中的白色物质一定存在;③写出装置b中发生反应的化学方程式:
?。
(3)问题讨论:
①电解CuCl2溶液后的阴极上发生的反应为:Cu2++2e-=Cu和?;②用石墨电极电解饱和硫酸铜溶液,观察阴极碳棒表面出现的现象红色物质附着,无白色物质,加入?后继续电解,出现白色物质。
参考答案:(16分)
(2)①否(l分)无水硫酸铜不变色说明没有氧元素(l分)②硝酸银溶液(l分)
③2CuCl+H2=2Cu+2HCl(2分)
(3)①Cu—e-+Cl-=CuCl;②NaCl溶液(或其它含氯离子的合理答案)(1分)
本题解析:
(2)①无水硫酸铜不变色说明没有氧元素,说明碳棒上的红色物质没有Cu2O;
②检测氯离子用硝酸银溶液。
③反应为:2CuCl+H2=2Cu+2HCl。
(3)①有+1价铜生成:Cu-e-+Cl-=CuCl;②加入氯离子看是否出现白色沉淀,可用NaCl溶液(或其它含氯离子的试剂)
本题难度:困难
4、选择题 下列结论均出自《实验化学》中的实验,其中不正确的是
A.硫酸铜溶液中加入过量的浓氨水,可得到深蓝色透明溶液
B.将氯化钴晶体溶于水,可得到粉红色的溶液
C.提取海带中的碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均过量
D.Zn-Cu原电池(如图)实验中,搅拌溶液可使灯泡亮度增加
参考答案:C
本题解析:分析:A.形成络离子;
B.晶体溶于水,离子有颜色;
C.过量强氧化剂(如氯气)能氧化碘单质;
D.搅拌加快离子的移动.
解答:A.硫酸铜溶液中加入过量的浓氨水,生成四氨合铜络离子,观察到深蓝色透明溶液,故A正确;
B.将氯化钴晶体溶于水,钴离子为粉红色,可得到粉红色的溶液,故B正确;
C.提取海带中的碘元素时,酸化后,加适量的H2O2将I-完全氧化为I2,故C错误;
D.搅拌溶液,加快离子的移动,可使灯泡亮度增加,故D正确;
故选C.
点评:本题考查化学实验方案的评价,涉及络离子、氧化还原、电化学等知识点,侧重基础知识和实验分析能力考查,题目难度较大.
本题难度:简单
5、填空题 A、B、C、D分别是HCl、BaCl2、AgNO3、Na2CO3 四种溶液中的一种,现将它们两两混合,现象如下表所示:
反应物
| A+B
| C+D
| A+D
| A+C
| B+D
|
现象
| 白色沉淀
| 白色沉淀
| 白色沉淀
| 白色沉淀
| 无色气体
|
由上述现象可推知A、B、C、D的化学式为:A________________? B________________? C________________? D________________
参考答案:(4分) A? AgNO3? B HCl? C? BaCl2? D Na2CO3
本题解析:A能与另外三种物质反应生成白色沉淀,所以A是硝酸银;B和D反应生成无色气体,说明BD是盐酸和碳酸钠,因此C是氯化钡;氯化钡能和碳酸钠反应生成碳酸钡沉淀,所以D是碳酸钡,因此B是盐酸。
本题难度:一般