微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如下图所示,则下列有关说法中正确的是
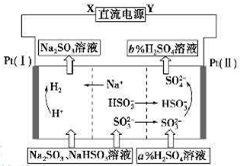
A.X为直流电源的正极,Y为直流电源的负极
B.阳极区pH减小
C.图中的b<a
D.阴极的电极反应为HSO3——2e—+H2O=SO42—+3H+和 SO32——2e—+2H2O=SO42—+4H+
参考答案:B
本题解析:因为电解池左室H+→H2,Pt(I)是阴极,X为直流电源的负极,A错误;电解池右室阳极区的发生反应HSO3——2e—+H2O=SO42—+3H+?和 SO32——2e—+2H2O=SO42—+4H+,故pH减小,B正确;D错误;C.图中的b<a
本题难度:一般
2、填空题 Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。

(1)A必须添加温度控制装置,除酒精灯、温度计外,还需要的玻璃仪器有 ?。
(2)反应后在装置C中可得NaClO2溶液。已知在温度低于38℃时NaClO2饱和溶液中析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上右图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤: ① 蒸发结晶;②?;③ 洗涤;④ 干燥。
(3)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:① 准确量取ClO2溶液V1mL加入到锥形瓶中,加适量蒸馏水稀释,调节试样的pH≤2.0。② 加入足量的KI晶体,静置片刻。此时发生反应的离子方程式为:?;③ 加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定,至终点时消耗Na2S2O3溶液V2 mL。则原ClO2溶液的浓度为?mol/L(用含字母的代数式表示)。(已知2 Na2S2O3+I2= Na2S4O6+2NaI)
Ⅱ.将由Na+、Ba2+、Cu2+、SO42-、Cl- 组合形成的三种强电解质溶液,分别装入下图装置
中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极。

接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响)。据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式?;
(2)电极f上发生的电极反应为?;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是?。
参考答案:I. (1)?烧杯? (2分)?(2) 趁热过滤?(2 分)
(3)2ClO2 + 8H+ + 10I-="==2" Cl—+ 5I2?+ 4H2O?(3 分)? ?(2 分)
?(2 分)
Ⅱ.(1)2CuSO4 + 2H2O  ?2Cu + O2↑ + 2H2SO4(2分)?
?2Cu + O2↑ + 2H2SO4(2分)?
(2)4OH--4e-=2H2O + O2↑(2分)
(3)向丙烧杯中加入2.25g水(3分)
本题解析:Ⅰ.(1)本题要结合题干所给信息解答。题干中提到制备二氧化氯是由潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得的,因此暗示该反应需要控制反应温度。控制该反应温度在60℃,可以选择60℃的热水浴。因此热水浴的温度控制装置除酒精灯、温度计外,还需要的玻璃仪器应该是能装水浴加热用的大烧杯。
(2)题中已说明NaClO2溶液容易得到2中晶体,而低于38℃时NaClO2饱和溶液中析出晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2 ,因此要得到无结晶水的NaClO2 晶体,要保证在过滤的时候温度高于38℃,因此采用趁热过滤。
(3)酸化的ClO2溶液中加入KI晶体后,溶液变蓝,说明有碘单质生成,所以发生的氧化还原反应离子方程式为2ClO2 + 8H+ + 10I-="==2" Cl—+ 5I2?+ 4H2O。
根据已知反应方程式关系得:n(ClO2)="2/5" n(I2) , n(I2)="1/2" n(Na2S2O3),因此n(ClO2)="1/5" n(Na2S2O3)。所以c (ClO2 )= 1/5×c×V2 ÷V1 =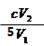 mol/L
mol/L
Ⅱ.从常温下各烧杯中溶液pH与电解时间t的关系图可知,甲、丙两烧杯起始pH值等于7,甲、丙的电解质溶液是强酸强碱盐;乙烧杯起始pH值小于7,电解质溶液为强酸弱碱盐。乙烧杯的电极C质量增重,则可推断增重原因为有金属Cu析出,该电极是阴极,并由此可以得出电源M为负极,N为正极;a、c、e为阴极,b、d、f为阳极。
(1)乙烧杯的电极C质量增重,阴极为Cu2+放电;溶液pH值逐渐降低,说明溶液中阳极OH-放电,使溶液中氢离子增多;所以根据放电情况可以推测得出乙中的电解质溶液为CuSO4溶液,因此电解该溶液的化学方程式为2CuSO4 + 2H2O  ?2Cu + O2↑ + 2H2SO4 。
?2Cu + O2↑ + 2H2SO4 。
(2)丙烧杯中的电解质是强酸强碱盐,随着电解的进行,丙中的溶液pH值不变,则阴极e为H+放电,阳极f上OH-放电,电解实质在电解水,由此可推测该电解质溶液是Na2SO4,因此f电极反应式为4OH--4e-=2H2O + O2↑。
(3)乙烧杯中c电极质量增加了8g,则生成了0.125mol的单质Cu,则转移电子0.25mol,因此丙烧杯中电解消耗0.125mol的水,要使溶液恢复,应该加入0.125mol的水,即2.25g水。
本题难度:困难
3、选择题 右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是(?)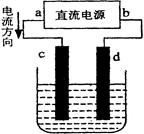
A.b为正极、a为负极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
参考答案:C
本题解析:电流从电源的正极经过用电器流回到电源的负极。A. 根据题图可知a的电源的正极,b是电源的负极。错误。B.与电源的正极a相连接的电极c为阳极,与电源的负极b相连接的电极d为阴极。错误。C.在电解过程中,由于阳离子的放电能力Cu2+>H+,所以在阴极发生反应:Cu2++2e-=Cu。产生的Cu附着在阴极d上,所以d电极质量增加。正确。D.在电解过程中,阴离子的沸点能力:Cl-> OH-,所以在阳极的电极反应式为:2Cl--2e-=Cl2 ↑。氯离子浓度会不断减小。错误。
本题难度:一般
4、选择题 镍氢充电电池(Ni-MH,KOH作为电解液)已经开始用于汽油/电动混合动力汽车上,该电池的总反应方程式如下:Ni(OH)2+M NiOOH+MH (M表示储氢合金),下列叙述正确的是
NiOOH+MH (M表示储氢合金),下列叙述正确的是
[? ]
A.放电时正、负极附近溶液的pH均不变
B.放电时正极材料为MH,发生氧化反应
C.充电时阳极反应为:Ni(OH)2 + OH--e-=== NiOOH + H2O
D.放电时每转移1mol电子,负极有1mol NiOOH被还原
参考答案:C
本题解析:
本题难度:一般
5、选择题 设NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.71 g氯气被还原得到的电子数为2NA
B.100 mL l mol·L-1的碳酸钠溶液中含有的CO32-数为0.1NA
C.标准状况下,2.24 L苯中含有的碳原子数为0.6 NA
D.用含有少量锌、铁、银等杂质的粗铜作阳极电解精炼,当阴极析出64 g金属时阳极失去的电子数小于2NA