微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。
(1)一定条件下,2SO2(g)+O2(g)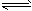 2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和
2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和
0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=
_________;恒温下,若往容器中再加入2 mol SO2(g),则重新达到平衡时SO2的总转化率_______50%(选填“>”、“<”或“=”)。
(2)用CH4催化还原NOx为N2可以消除氮氧化物的污染。现有1L NO2、NO混合气体NOx,将其还原成
N2,需同温同压下CH4的体积0.4L,则混合气体中NO2、NO的物质量之比为_________。
(3)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示
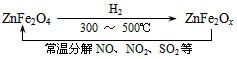
若2mol ZnFe2Ox与SO2可生成0.75 mol S,x=_________。求可分解⑵中混合气体体积V(标准状况下)。(写出计算过程)
参考答案:(1)5.76;<
(2)3∶2
(3)3.25;21
本题解析:
本题难度:一般
2、选择题 一定温度下,在2L 的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示。下列描述正确的是
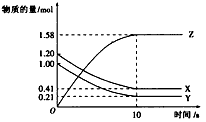
[? ]
A.反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到 l0 s,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s,Y的转化率为79.0%
D.反应的化学方程式为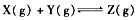
参考答案:C
本题解析:
本题难度:简单
3、选择题 反应4A(g) + 5B(g) 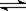 ?4C(g) + 6D(g) △H =-Q kJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是:
?4C(g) + 6D(g) △H =-Q kJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是:
A.若增大压强,A和B的转化率都增大
B.若升高温度最终能生成更多的C和D
C.单位时间里有4n mol A消耗,同时有5n mol B生成
D.容器里A、B、C、D的浓度比是4:5:4:6
参考答案:C
本题解析:该反应是体积增大的放热的可逆反应。增大压强,平衡向逆反应方向移动,A和B的转化率都减小,A不正确。升高温度平衡也向逆反应方向移动,不利于CD的生成,B不正确。平衡后单位时间里有4n mol A消耗,必然同时生成4n mol A,根据速率之比是化学计量数之比,同时也应该生成5n mol B,C正确。达到平衡后容器里A、B、C、D的浓度比不一定是4:5:4:6 ,D不正确。
本题难度:简单
4、选择题 已知300℃、70MPa下由二氧化碳和氢气合成乙醇的反应成为现实:
2CO2(g)+6H2(g) ?CH3CH2OH(g)+3H2O(g)。在温度为T℃,容积不变的密闭容器中,将3molH2和1molCO2混合,达到平衡时乙醇气体的体积分数为a,下列有关说法正确的是
?CH3CH2OH(g)+3H2O(g)。在温度为T℃,容积不变的密闭容器中,将3molH2和1molCO2混合,达到平衡时乙醇气体的体积分数为a,下列有关说法正确的是
A.升高温度,该反应的平衡常数将增大
B.再向该容器中充入1molH2和1molCO2,达到平衡时,H2的转化率将高于CO2
C.加入催化剂或从平衡混合气中分离出水蒸气均可提高CO2和H2的利用率
D.T℃,在容积可变的密闭容器中将3molH2和1molCO2混合,达到平衡时乙醇的体积分